
锌锰干电池由于其贮存和使用寿命较短,大都为一次性电池,用完之后被当作垃圾扔掉。这不仅浪费了宝贵的金属资源,而且还会产生严重的环境污染。下表是各类电池的综合成分分析结果:
| 元素 | 锌 | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |
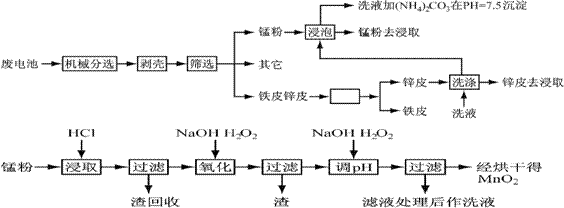
通过简单的机械处理,将电池中各组分进行最大在限度的分离,从而使整个处理过程得到简化。再分别对锌皮和锰粉(MnO2)进行湿法处理,通过预处理、浸取、净化等工序制出产品。工艺流程如下图:
查阅资料知各离子沉淀完全的pH为
| 离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
已知:锌元素与铝元素相似,具有两性。
1、市售锌锰干电池为碱性电池,电解质溶液为KOH,则其正极反应为 ;
电极总反应方程为 ;
2、在预处理中,分离铁皮和锌皮的方法是 ,洗液加(NH4)2CO3在pH=7.5沉淀出一种碱式盐,该物质的化学式为 。
3、二氧化锰生产中,写出加入30%盐酸溶解时的离子方程式 ;盐酸溶解后回收的渣是 ;
4、已知第二次加H2O2后调节pH≈9的目的为将Mn2+转化为MnO2,则第一次加H2O2后调节pH≈5,目的是 ;
5、实验室中用高锰酸钾溶液检验Mn2+时,产生黑色沉淀,该反应的离子方程式为
;
6、硫酸锰在高温条件下可以得到三种氧化物,该热分解的方程式为 。
【知识点】常见离子检验、除杂、电化学、离子方程式的书写
【答案解析】 1、2MnO2+2H2O+2e-=2MnOOH+2OH- (1分)
2MnO2+2H2O+Zn=2MnOOH+Zn(OH)2 (1分)
2、磁选法或用磁铁吸 (1分) Zn2(OH)2CO3 (2分)
3、MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (2分) 碳黑(或碳) (1分)
Mn2++Cl2↑+2H2O (2分) 碳黑(或碳) (1分)
4、除去Fe2+和Fe3+ (2分)
5、2MnO4-+3Mn2++4OH-=5MnO2+2H2O (2分)
6、3MnSO4 Mn3O4+SO2↑+SO3↑ (2分)
Mn3O4+SO2↑+SO3↑ (2分)
解析:1、锌锰干电池负极为锌,失电子,正极为石墨,二氧化锰得电子生成MnOOH,正极电极反应式:2MnO2+2H2O+2e-=2MnOOH+2OH-;总反应方程式:
2MnO2+2H2O+Zn=2MnOOH+Zn(OH)2;
2、在预处理中,分离铁皮和锌皮的方法是磁选法或用磁铁吸;洗液加(NH4)2CO3在pH=7.5沉淀出一种碱式盐,该物质是碱式碳酸锌,化学式为Zn2(OH)2CO3;
3、二氧化锰生产中,加入30%盐酸溶解时,生成氯化锰和氯气,离子方程式为:
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O; 盐酸溶解后回收的渣是碳黑;
Mn2++Cl2↑+2H2O; 盐酸溶解后回收的渣是碳黑;
4、第一次加H2O2后,将亚铁离子氧化成铁离子,调节pH≈5,将铁离子完全沉淀;故目的是除去Fe2+和Fe3+;
5、高锰酸钾溶氧化Mn2+生成黑色的MnO2,方程式:2MnO4-+3Mn2++4OH-=5MnO2+2H2O
6、硫酸锰在高温条件下可以得到三种氧化物:氧化锰、二氧化硫、三氧化硫,方程式:
3MnSO4 Mn3O4+SO2↑+SO3↑
Mn3O4+SO2↑+SO3↑
【思路点拨】本题以碱性锌锰电池为依据考查了电极反应式书写、氧化还原反应方程式书写、分解反应等,注意流程中的信息;难度中等。


科目:高中化学 来源: 题型:
下列实验装置、选用的试剂或实验操作中,都正确的是( )

A.实验室用装置A制取氨气 B.用B装置吸收氨气,并防止倒吸
C.用C装置稀释浓硫酸 D.用D装置除去CO2中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
右图小试管内为红墨水,具支试管内盛有pH=4久置的雨水和生铁片。实验观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水回升时,碳电极反应式为O2+2H2O+4e-===4OH-
D.具支试管中溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是 D
| 选项 | 叙述I | 叙述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某校研究性学习小组同学在实验时把SO2通入装有1mol/LBaCl2溶液的试管中,出现了白色浑浊物。
(1)实验小组的同学根据沉淀溶解平衡原理查阅了工具书上的相关数据,经过计算推导得出:常温下即使把SO2通入1mol/L BaCl2溶液中至饱和,也不可能生成BaSO3沉淀,故白色浑浊物只能是BaSO4。你认为所查阅的数据为: 。
(2)二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象.为了避免产生沉淀,某化学小组设计了如下实验装置,实验操作步骤如下:

①气密性检查完好后,在装置A中的多孔隔板上放上锌粒,通过 全【品教学网, 用后离不了!注入稀硫酸.打开活塞,将产生的氢气导入到后续装置.
②D中气泡均匀冒出并验纯全【品教学网, 用后离不了!后关闭活塞,将装置D的导管插入烧杯中。
③通过装置B的 全【品教学网, 用后离不了!滴加浓硫酸,产生的气体进入到BaCl2溶液中,溶液保持澄清。
④打开活塞,将产生的氢气导入后续装置一段时间。
⑤将盛有BaCl2溶液的试管从装置中取出,拔去橡皮塞用胶头滴管伸入到苯层下方滴加双氧水,随即出现白色浑浊,滴加稀盐酸并振荡,白色浑浊不消失。
⑥拆卸装置,清洗仪器,处理剩余药品。
请回答下列问题
(2)实验步骤①和③的空白处使用的仪器名称分别为 、 全【品教学网, 用后离不了!;
(3)反应开始前,先向制取SO2的装置中通入纯净的A中产生的氢气,其作用是: 。
(4)装置C中苯的作用是 。
(5)装置D的目的是 全【品教学网, 用后离不了!
(6)写出实验步骤⑤试管中发生反应的化学方程式 、 全【品教学网, 用后离不了!;
查看答案和解析>>
科目:高中化学 来源: 题型:
从海带中提取碘的实验过程中(萃取剂用苯),涉及到下列操作,其中正确的是




A.将海带灼 B.过滤得含 C.放出碘的 D.分离碘并回收苯
烧成灰 I-溶液 苯溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是
| 选项 | 目的 | 分离方法 | 原理 |
| A. | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C. | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| D. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,分别对反应C(s)+CO2(g)2CO(g)(正向吸热)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是( )
A.①②③④ B.①③④
C.①② D.①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com