
| A. | CH3CH2CH2CH2CH2OH | B. | 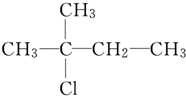 | ||
| C. | 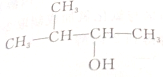 | D. | 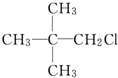 |
分析 能跟H2加成生成2-甲基丁烷,说明Y和Z均为分子中含5个C原子的不饱和烃,其碳骨架为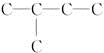 .氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基,据此分析选项是否符合以上碳架及消去反应生成两种烯烃即可.
.氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基,据此分析选项是否符合以上碳架及消去反应生成两种烯烃即可.
解答 解:根据能跟H2加成生成2-甲基丁烷,说明Y和Z均为分子中含5个C原子的不饱和烃,其碳骨架为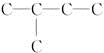 ,氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基.
,氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基.
A.CH3CH2CH2CH2OH没有支链,故A错误;
B.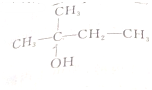 含有支链,能发生消去反应生成2种烯烃:(CH3)2C=CHCH3、CH3C(CH2CH3)=CH2,故B正确;
含有支链,能发生消去反应生成2种烯烃:(CH3)2C=CHCH3、CH3C(CH2CH3)=CH2,故B正确;
C.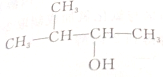 中含有一个支链甲基,发生消去反应生成2种烯烃:(CH3)2C=CHCH3、(CH3)2CHCH=CH2,故C正确;
中含有一个支链甲基,发生消去反应生成2种烯烃:(CH3)2C=CHCH3、(CH3)2CHCH=CH2,故C正确;
D.(CH3)3CCH2Cl有两个支链,且不是醇,属于氯代烃,故D错误;
故选BC.
点评 本题主要考查了有机物结构简式的推断,熟悉卤代烃消去的规律和烯烃的加成特点是解题的关键.


科目:高中化学 来源: 题型:选择题
| 共价键 | C--C | C=C | C--H | H一H |
| 键能(KJ•mol-1) | 348 | 610 | 413 | 436 |
 (g)+3H2(g)→
(g)+3H2(g)→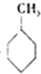 (g)△H=-384KJ•mol-1
(g)△H=-384KJ•mol-1| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 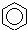 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$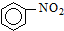 +H2O;取代反应 +H2O;取代反应 | |
| B. | CH4+Cl2→CH3Cl+HCl;置换反应 | |
| C. | CH2=CH2+HCl→CH3-CH2Cl;加成反应 | |
| D. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O;氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH4 | CO2 | CO | H2 |
| 物质的量mol | 2 | 2 | 8 | 8 |
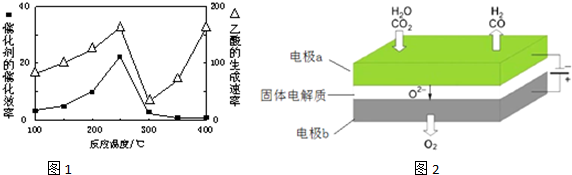
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、糖类和蛋白质是三大营养物质,都能发生水解;被称作“人体核武器”的维生素B2含有肽键结构等,也能发生水解 | |
| B. | 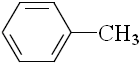 、 、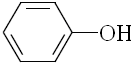 和 和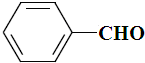 ,仅第一种能使KMnO4酸性溶液褪色 ,仅第一种能使KMnO4酸性溶液褪色 | |
| C. | 氨基酸主要以内盐形式存在,调节溶液的pH不可改变它在水中的溶解度 | |
| D. | 体检报告单中的“甘油三酯”是甘油的衍生物,其中甘油结构简式是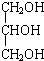 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com