
����Ŀ������ͭ��ȡ��M��ͨ�����·�Ӧʵ��ͭ���ӵĸ�����
��1��X������ˮ���������л��ܼ����侧������Ϊ��
��2��X����sp2�ӻ���sp3�ӻ���ԭ�ӵĵ�һ�������ɴ�С˳��Ϊ��
��3��������Ӧ�ж��Ѻ����ɵĻ�ѧ����������ţ���
a.���Ӽ� b.��λ�� c.������ d.���»��� e.���ۼ�
��4��M��W�����ӽṹ��ͼ����ȣ�M��ˮ����С��������Cu2+����ȡ��Mˮ����С����Ҫԭ������
��5������ͭ���壬�׳����������������д��£�����ⶾ�ȹ�Ч��ȡ5.0 g������Ʒ�������¶�ʹ��ֽ⣬�ֽ���̵��������±����ش��������⣺
�¶ȷ�Χ/�� | ��������/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000���� | 1.44 |
��ͼ������ͭ����ֽ�õ�һ���¶ȵIJ���ľ���(����ͺ��������ͬ��ԭ��)��
�ٸ��¶�����
��ͭԭ�ӵ���λ������
���𰸡�
��1�����Ӿ���
��2��N��O��C
��3��be
��4��M���γɷ����������ʹ�ܽ�ȼ�С
��5��1000�����ϣ�4
���������⣺��1����������X�Ľṹ��ʽ�жϣ�X������ˮ���������л��ܼ�����XΪ���Ӿ��壬
���Դ��ǣ����Ӿ��壻
��2��������X�б���C���ʻ�C��sp2�ӻ�����sp3�ӻ���ʽ��ԭ����O��N��C������Nԭ��2p������������һ�����ܸ���O����һ�������ɴ�С˳��Ϊ��N��O��C��
���Դ��ǣ�N��O��C��
��3���ɽṹ��ʽ��֪X�����д�����λ�����ۼ���
���Դ��ǣ�be��
��4������M���γɷ�����������������ܽ�ȼ�С��
���Դ��ǣ�M���γɷ����������ʹ�ܽ�ȼ�С��
��5������ͼ��֪��ֻ����2��ԭ�ӣ���ΪCu��O���þ�����Oԭ����Ϊ1+8��![]() =2��
=2��
Cuԭ����Ϊ4���仯ѧʽΪCu2O������ͭ�����ʵ���=![]() =0.02mol��
=0.02mol��
������ͭ������=0.01mol��144g/mol=1.44g�����Լ����¶���1000�����ϣ����Դ��ǣ�1000�����ϣ�
����ͼ��֪Cu����λ��Ϊ4�����Դ��ǣ�4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ�ģ� ��
A.����������Һ��ͨ�����������������壺2ClO��+SO2+H2O�T2HClO+SO ![]()
B.��NaAlO2��Һ��ͨ����CO2��AlO ![]() +CO2+H2O�TAl��OH��3��+CO
+CO2+H2O�TAl��OH��3��+CO ![]()
C.��·�帯ʴҺ�еķ�Ӧ��Cu+2Fe3+�T2Fe2++Cu2+
D.С�մ���Һ��NaOH��Һ��ϣ�HCO ![]() +OH���TCO2��+H2O
+OH���TCO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾʵ��װ�ÿ�������ȡ��Ȳ�� 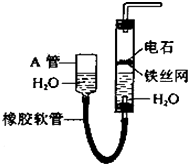
����գ�
��1��A�ܵ������� �� ��ȡ��Ȳ�Ļ�ѧ����ʽ�� ��
��2����Ȳͨ��KMnO4������Һ�й۲쵽�������� �� ��Ȳ��������Ӧ��
��3����Ȳͨ����ˮ��CCl4��Һ�й۲쵽�������� ��
��4��Ϊ�˰�ȫ����ȼ��ȲǰӦ �� ��Ȳȼ��ʱ��ʵ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaClO2)��һ����Ҫ�ĺ�������������Ҫ����ˮ�������Լ�ɰ�ǡ���֬��Ư����ɱ���������ǹ������ⷨ�����������ƵĹ�������ͼ��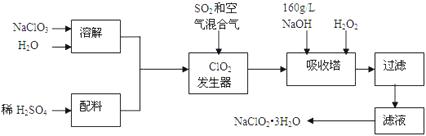
��֪����NaClO2���ܽ�����¶����߶������ʵ������¿ɽᾧ������ƷNaClO23H2O��
�ڴ�ClO2�ֽⱬը��һ����ϡ����������ϡ�͵�10�����¡�
��1���������з�����Ӧ�����ӷ���ʽΪ���������й�����������ÿ�������
a.��SO2������SO3 �� ��ǿ���� b.��NaClO3��ԭΪClO2 c.ϡ��ClO2�Է�ֹ��ը
��2���������ڷ�����Ӧ�Ļ�ѧ����ʽΪ���������ڵ��¶Ȳ��ܳ���20�棬��Ŀ������
��3����������Ϊ��ֹNaClO2����ԭ��NaCl�����û�ԭ���Ļ�ԭ��Ӧ���С����»�����ѡ��Ļ�ԭ����(ѡ�����)��
a.Na2O2 b.Na2S c.FeCl2
��4������Һ�еõ�NaClO2��3H2O�־����ʵ�������������
��5��ijѧϰС���õ������ⶨ�ֲ�Ʒ���������Ƶĺ�����ʵ�����£�
a.ȷ��ȡ��������������Ʒm g��С�ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ�������û��Һ���250 ml������Һ��(��֪��ClO2��+4I��+4H+=2H2O+2I2+Cl��)
b.��ȡ25.00 ml������Һ����ƿ�У��Ӽ��ε�����Һ����c mol��L-1 Na2S2O3��Һ�ζ����յ㣬�ظ�2�Σ����ƽ��ֵΪV ml ��(��֪��I2+2S2O32-=2I��+S4O62��)
�ٴﵽ�ζ��յ�ʱ������Ϊ ��
�ڸ���Ʒ��NaClO2����������Ϊ (�ú�m��c��V�Ĵ���ʽ��ʾ������������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ca3(PO4)2��SiO2 ����̿��Ϊԭ�������轺��SiO2��nH2O�����ס����ἰCH3OH�����й��չ���ԭ���ۺ������ʸߣ��������١�
��1��������Ӧ�У������û���Ӧ������ѡ����������������������������ݡ�
��2�������½��еķ�Ӧ��Ļ�ѧ����ʽΪ�����������CaSiO3������������һ�����ɣ�
��3����Ӧ�����ڸ�����������ˮ�����½��У���ԭ������
��4��CH3OH������ȼ�ϵ�ص�ȼ�ϣ���ǿ���Խ����У������ĵ缫��ӦʽΪ��
��5��ָ����VI����һ�����ڹ�ҵ�����ϵ�������
��6��д����P��H3PO4���йط�Ӧʽ��
����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£����Ϊ2L���ܱ������У�NO2��N2O4֮�䷢����Ӧ��2NO2��g��������ɫ��N2O4��g������ɫ������ͼ��ʾ�� 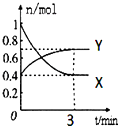
��1���������X����Y������ʾNO2�����ʵ�����ʱ��ı仯���ߣ�
��2���������¶ȣ���v������ �� v���棩 �� ����ӿ족�� �������䡱����
��3����������Ӧ�ڼס���������ͬ������ͬʱ���У��ֱ��ü���v��NO2��=0.3mol/��Ls��������v��N2O4��=6mol/��Lmin�������з�Ӧ���죮
��4����0��3min����N2O4�ķ�Ӧ����Ϊ ��
��5������������˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬���ǣ����ţ��� A��v��NO2��=2v��N2O4��
B��������ѹǿ���ٷ����仯
C��X������������ٷ����仯
D������������ԭ���������ٷ����仯
E����ͬʱ��������n mol��Y��ͬʱ����2n mol��X
F����ͬʱ��������n mol��Y��ͬʱ����2n mol��X��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�����У���������������( )
A. H + H �� H2B. H + Cl ��HCl
C. I2��I + ID. C+O2��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������A��B��C�������ʣ��������壩����̶����Ϊ10L���ܱ������У�һ�������·�����Ӧ��һ��ʱ���ڲ�ø����ʵ����仯��ͼ��ʾ�� �����������⣺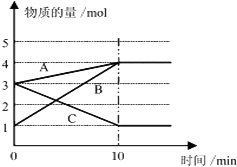
��1����Ӧ�Ļ�ѧ����ʽ��A��B��C�ɱ�ʾΪ ��
��2����B��Ũ�ȱ仯��ʾ��0��10min�ڵķ�Ӧ������ ��
��3���ڸ������ﵽ��Ӧ���ȣ�ƽ��״̬��ʱ��Ӧ���ת���ʣ�ת���ʨTת�������ʵ���/��ʼ���ʵ�����100%������������1λС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����X��Na2O��Fe2O3��Cu��SiO2�е�һ�ֻ���������ɣ�ij��ȤС��������;���ֱ��X��������ʵ��̽���������й�˵������ȷ���ǣ� �� 
A.���жϻ�������Ƿ���Na2O
B.�ɢ��֪X��һ������SiO2
C.1.92g����ɷ�ΪCu
D.15.6g�����X��m��Fe2O3����m��Cu��=1��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com