
硫酸亚铁铵的制备
1、硫酸亚铁铵晶体的性质
物理性质:浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小
化学性质:能水解;具有还原性,但比硫酸亚铁稳定
2、将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体。
(NH4)2SO4+FeSO4+ 6H2O= (NH4)2SO4•FeSO4•6H2O↓根据下图回答:

(1)步骤1Na2CO3的主要作用是 。
(2)步骤2中铁屑过量的目的是(用离子方程式表示):
(3)步骤3中,加入(NH4)2SO4固体后,要得到摩尔盐晶体,需经过的实验操作包括:加热蒸发、 、 。
(4)步骤3中制得的晶体过滤后用无水乙醇洗涤的目的是 。
操作对比:
1、三个步骤中都含有加热的操作:
步骤1中:小火加热的目的是:
;
步骤2中:水浴加热的优点是 ;
水浴加热是为了 ;
步骤3中:加热是为了蒸发溶剂,浓缩结晶。
思考:该实验中,要得到摩尔盐晶体,应加热到 时,停止加热。
为什么不能蒸干?
那么蒸发下列溶液呢?
①从CuSO4溶液得到胆矾晶体: 。
②从NaCl溶液得到NaCl固体:
2、三个步骤中都含有固液分离的操作:
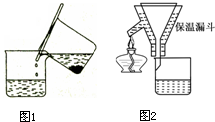
步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有:
A、沉淀的颗粒较大 B、沉淀容易沉降
C、沉淀呈胶状 D、沉淀呈絮状
步骤2中溶液趁热过滤的原因是 。
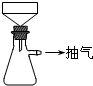
步骤3中可以用如下装置进行过滤:
(1)这种过滤方式称为:
(2)这种过滤跟普通过滤相比,除了过滤速度快外,
还有一个优点是: 。
(3)你能讲出仪器A、B、C的名称么?
(1)除去铁屑表面的油污 (2)Fe + 2Fe3+ = 3Fe2+ (3)加热蒸发、冷却结晶、过滤。
(4)利用乙醇的挥发,除去晶体表面附着的水分。
操作对比:
1、三个步骤中都含有加热的操作:
步骤1中:小火加热的目的是:升温,溶液碱性增强,去油污能力增强
步骤2中:水浴加热的优点是:受热均匀、便于控制温度;
水浴加热是为了加速铁的溶解;
步骤3中:加热是为了蒸发溶剂,浓缩结晶。
思考:该实验中,要得到摩尔盐晶体,应加热到溶液表面出现晶膜时,停止加热。
为什么不能蒸干?蒸干时溶液中的杂质离子会被带入晶体中;
蒸干时晶体会受热分解或氧化
那么蒸发下列溶液呢?
①从CuSO4溶液得到胆矾晶体:加热到溶液表面出现晶膜时,停止加热。
②从NaCl溶液得到NaCl固体:加热到大量晶体析出时,停止加热,用余热蒸干
2、三个步骤中都含有固液分离的操作:
步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有:
A、沉淀的颗粒较大 B、沉淀容易沉降
C、沉淀呈胶状 D、沉淀呈絮状
步骤2中溶液趁热过滤的原因是防止溶液冷却时,硫酸亚铁因析出而损失 。
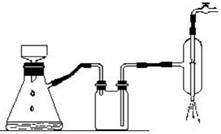 步骤3中可以用如下装置进行过滤:
步骤3中可以用如下装置进行过滤:
(1)这种过滤方式称为:减压过滤(也称抽滤或吸滤)
(2)这种过滤跟普通过滤相比,除了过滤速度快外,
还有一个优点是:得到较干燥的沉淀。
(3)你能讲出仪器A、B、C的名称么?
略


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:阅读理解
 硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:
硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
 【实验化学】
【实验化学】查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
A.(12分)【物质结构与性质】
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
⑴科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ·mol-1) | 786 | 715 | 3 401 |
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 ▲ 。
⑵科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。

①写出基态Cu原子的核外电子排布式 ▲ ;金属铜采用下列 ▲ (填字母代号)堆积方式。
 |
A B C D
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) ▲ 。
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响 ▲ 。
④SO42-的空间构型是 ▲ 。
B.(12分)【实验化学】
硫酸亚铁铵的化学式为(NH4)2SO4·FeSO4·6H2O,又名莫尔盐,是分析化学中常见的还原剂。某化学研究小组设计如下实验来制备莫尔盐并测定硫酸亚铁铵的纯度。
步骤一:铁屑的处理与称量。在盛有适量铁屑的锥形瓶中加入Na2CO3溶液,加热,过滤、洗涤、干燥、称量,质量记为m1。
步骤二:FeSO4的制备。将上述铁屑加入到一定量的稀H2SO4中,充分反应后过滤并用少量热水洗涤锥形瓶和滤纸。滤液及洗涤液完全转移至蒸发皿中。滤渣干燥后称重,质量记为m2。
步骤三:硫酸亚铁铵的制备。准确称取所需质量的(NH4)2SO4加入“步骤二”中的蒸发皿中,缓缓加热一段时间后停止,冷却,待硫酸亚铁铵结晶后过滤。晶体用无水乙醇洗涤并自然干燥,称量所得晶体质量。
步骤四:用比色法测定硫酸亚铁铵的纯度。
 回答下列问题:
回答下列问题:
⑴步骤三中称取的(NH4)2SO4质量为 ▲ 。
⑵①铁屑用Na2CO3溶液处理的目的是 ▲ 。制备FeSO4溶液时,用右图装置趁热过滤,原因是 ▲ 。
②将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机是 ▲ 。
③比色法测定硫酸亚铁铵纯度的实验步骤为:Fe3+标准色阶的配制、待测硫酸亚铁铵溶液的配制、比色测定。标准色阶和待测液配制时除均需加入少量稀HCl溶液外,还应注意的问题是 ▲ 。
④该实验最终通过 ▲ 确定硫酸亚铁铵产品等级。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁铵[ (NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用下所示方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。将处理好的铁屑放入锥形瓶,加入过量的3 mol·L-1H2SO4溶液,加热至充分反应为止。趁热过滤(如图所示),收集滤液和洗涤液。
步骤3:硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)步骤1中图13分离方法称为 法。
(2)步骤2中有一处明显不合理的是 。趁热过滤的理由是 。
(3)步骤3加热浓缩过程中,当 时停止加热。用无水乙醇洗涤晶体的原因是 。
(4)FeSO4·7H2O在潮湿的空气中易被氧化成Fe(OH)SO4·3H2O,写出该反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com