
(16分)高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为:

已知: Ⅰ. SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①加快反应速率的措施有 (写一种)。
碳酸锶与盐酸反应的离子方程式 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为_______。
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)步骤④的操作是 、 。
(6)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(16分) (1)加热、充分搅拌、适当增加盐酸浓度等(写一种) (2分)。
SrCOs+2H+= Sr2+ +CO2↑+H2O (2分)
(2)2Fe2++ H2O2 +2H+=2Fe3++ 2H2O (3分)
(3)B(3分);
(4)Fe(OH)3、BaSO4 (2分)
(5)蒸发浓缩 、冷却结晶(2分)
(6)A(2分)
【解析】
试题分析:(1)根据条件对反应速率的影响,加快反应速率的方法可以是搅拌、升温、增大盐酸的浓度等;碳酸锶难溶于水,所以离子方程式中不可拆,则碳酸锶与盐酸反应的离子方程式为SrCOs+2H+= Sr2+ +CO2↑+H2O;
(2)根据题目所给条件,过氧化氢氧化亚铁离子生成水和铁离子,离子方程式为2Fe2++ H2O2 +2H+=2Fe3++ 2H2O;
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4目的是使钡、铁离子沉淀,但不能引入新的杂质,所以选择氢氧化锶,答案选B;
(4)根据流程图分析,pH=4时铁离子沉淀完全,所以操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4
(5)由滤液得到晶体需通过蒸发浓缩、冷却结晶的方法得到固体,然后再过滤可得氯化锶晶体;
(6)SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水,所以用热风吹干六水氯化锶,适宜的温度应低于61℃,答案选A。
考点:考查工艺流程的分析,离子方程式的书写,实验方案的设计,实验操作的判断


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:选择题
石墨烯是一种由碳原子组成六角形成蜂巢晶格的平面薄膜,其结构模型见右图。下列关于石墨烯的说法正确的是( )

A.是一种新型化合物 B.与石墨互为同位素
C.晶体中碳原子键全部是碳碳单键 D.是一种有发展前途的导电材料
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列实验能达到相应目的的是
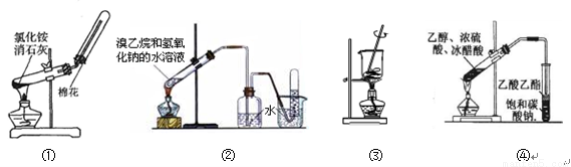
A.用图①装置制取并收集氨气 B.用图②装置制取和收集乙烯
C.用图③装置将海带灼烧成灰 D.用图④装置制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2015届广东省深圳市高三上学期第一次五校联考理综化学试卷(解析版) 题型:推断题
(16分)铝是用途广泛的金属材料,目前工业上主要用铝土矿(主要成分含氧化铝、氧化铁)来制取铝,其常见的过程如下:

请回答下列问题:
(1)沉淀B的化学式为 ,溶液C中阴离子主要是 。
(2)操作Ⅰ是 (填操作名称)
(3)写出①过程中发生反应的离子方程式 。
(4)Al(OH)3沉淀必须进行洗涤才能通过操作Ⅳ获得纯净Al2O3,操作Ⅳ是 (填操作名称),简述洗涤沉淀的操作方法: 。
(5)生产过程中,除水、CaO和CO2可以循环使用外,还可循环使用的物质有 (填化学式)。
(6)电解Al2O3制取金属Al的阳极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省深圳市高三上学期第一次五校联考理综化学试卷(解析版) 题型:选择题
下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=3的H2SO4溶液中:c(H+)=10-3mol·L-1
B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)>c(CH3COO-)
C.在Na2CO3溶液中,2c(Na+)= c(CO32-)+ c(HCO3-) + c(H2CO3)
D.氯化铵溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第一次调研考试化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述I | 叙述II |
A | NH4Cl为强酸弱碱盐 | 加热可除去NaCl中的NH4Cl |
B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期第一次质量检测化学试卷(解析版) 题型:推断题
(16分)以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
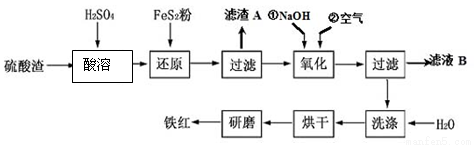
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为 ;
“滤渣A”主要成份的化学式为 。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + + H2O== 15Fe2 + + SO42- + 。
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 。
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是 (几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) 。
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市海珠区高三8月摸底考试理综化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.氢氧燃料电池中O2通入负极
B.铅蓄电池在放电时,其负极的电极反应为:Pb-2e=Pb2+
C.碱性锌锰电池在工作时,电解质中的OH-移向正极
D.在海轮外壳镶嵌锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源:2015届安徽省同步课时练(人教选修4)1.2 燃烧热能源试卷(解析版) 题型:选择题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g) CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )

A.CH3OH的燃烧热的ΔH=-192.9 kJ·mol-1
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+O2(g) CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com