
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数和核外电子数之差为
A.57 B.47 C.61 D.293
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年北京市东城区高三综合能力测试二理综化学试卷(解析版) 题型:实验题
(15分)实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。实验如下:
Ⅰ.用pH试纸检验,漂白液pH>7,饱和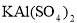 溶液pH<7。
溶液pH<7。
Ⅱ.取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅲ.另取10 mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色。
Ⅳ.再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色。
①漂白液pH大于7的原因是(用离子方程式表示)__________。
②由实验Ⅱ得出ClO-具有氧化性,写出反应的离子方程式__________。
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是__________。
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成。用下图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。
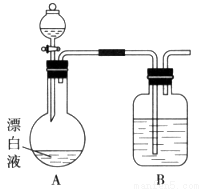
①装置B的作用是__________;盛放的药品是__________。
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式__________。
③若打开分液漏斗活塞向烧瓶中加入饱和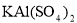 溶液,首先观察到产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生。A中加
溶液,首先观察到产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生。A中加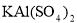 溶液反应的离子方程式是__________。
溶液反应的离子方程式是__________。
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2。若取10 mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省达州市高一3月月考化学试卷(解析版) 题型:填空题
(2013·华中师大一附中月考)下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质可在空气中燃烧。
W | X | Y |
Z |
请回答下列问题:
(1)Z的元素符号是 ,写出Z的原子结构示意图: 。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,该反应的离子方程式为 。
(3)探究同主族元素性质的一些共同规律,是学习化学的一项重要内容。在下表中列出对H2ZO3化学性质的推测,举例并写出相应的化学方程式(化学方程式中Z用元素符号表示)
编号 | 性质推测 | 化学方程式 |
示例 | 氧化性 | H2ZO3+4HI=Z↓+2I2+3H2O |
1 | ||
2 |
(4)由C、O和Y三种元素组成的化合物OCY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
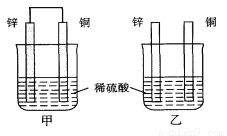
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均减小
D.产生气泡的速度甲比乙快
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se)的保健品已经进入市场,已知它与氧元素同族,与 K 同周期,关于硒的说法中不正确的是
A.原子序数为 34
B.最高价氧化物的水化物的分子式为:H2SeO4
C.Se的非金属性比 Br 弱
D.气态氢化物的稳定性比硫化氢气体强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省安庆市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
用湿法制磷酸副产品氟硅酸(H2SiF6 )生产无水氟化氢的工艺如下图所示:
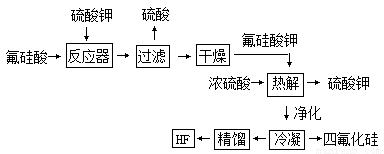
已知:氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于醇。在热水中水解成氟化钾、氟化氢及硅酸。
(1)写出反应器中的化学方程式:
(2)在实验室过滤操作中所用的玻璃仪器有: ;
在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤,其目的是: ;
(3)该流程中哪些物质可以循环使用: (用化学式表达)
(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6 ,试写出该反应方程式: ;
(5)为了测定无水氟化氢的纯度,取标况下的气体产物2.24L,测得质量为3.1g,并将气体通入含足量的Ca(OH)2 溶液中,得到5.85gCaF2沉淀,则无水氢氟酸质量分数为: 。(保留2位有效数字)通过计算结果,试解释,为什么标况下2.24L产物的质量远远大于2.0g, 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省安庆市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
为实现实验目的,其他主要仪器,所用试剂合理且需要在某个部位放置温度计的是
选项 | 实验目的 | 玻璃实验仪器 | 实验试剂 | 温度计位置 |
A | 制取乙烯 | 圆底烧瓶、集气瓶、带胶塞导气管、酒精灯 | 浓硫酸、乙醇 | 反应液中 |
B | 提纯乙醇 | 蒸馏烧瓶、冷凝管、锥形瓶、承接管 | 含杂质乙醇 | 支气管口 |
C | 中和热测定 | 烧杯、环形玻璃搅拌器 | 氢氧化钠、醋酸 | 酸、碱及反应液中 |
D | 制镜 | 烧杯、试管、酒精灯 | 银氨溶液、葡萄糖 | 水浴的烧杯水中 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁朝阳市三校协作体高三下学期第一次联考理综化学试卷(解析版) 题型:填空题
(15分)化合物AX3和单质X2在一定条件下反应可生成化合物AX5,该反应不能彻底。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5时,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)一定条件下,反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行a、b、c三组实验,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行a、b、c三组实验,反应体系总压强随时间的变化如图所示。

①用P0表示开始时总压强,P表示平衡时总压强,用α表示AX3的平衡转化率,则α的表达式为 。由此计算实验c中 AX3的平衡转化率:αc为 。若在实验a中再加入0.1mol AX5,再次达平衡后AX3的平衡转化率将 。(填“增大、减小或不变”)
②下列不能说明反应达到平衡状态的是 。
A.混合气体的平均相对分子质量保持不变
B.混合气体密度保持不变
C.体系中X2的体积分数保持不变
D.每消耗1 mol AX3的同时消耗1 mol AX5
③计算实验a从反应开始至到达平衡v(AX5)化学反应速率为 mol/(L·min)。(保留2位有效数字)
④图中3组实验从反应开始至到达平衡时的化学反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件是:b 、c 。该反应在实验a和实验c中的化学平衡常数的大小关系是Ka Kc(填“>、< 或 =”),其中Kc= (注意标明单位,且保留小数点后1位)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市朝阳区高三4月第一次综合练习理综化学试卷(解析版) 题型:选择题
如图为锌铜显示原电池装置图,下列说法不正确
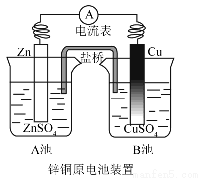
A.电子由Zn极流向Cu极
B.该装置的总反应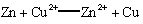
C.一段时间后,A池带正电荷,B池带负电荷
D.取出盐桥,电流计指针不再偏转
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com