
(1)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为 熔化时不需破坏化学键的是 ,熔化时只需破坏共价键的是 (填序号).
(2)在①H2、②(NH4)2SO4、③SiC、④CO2、⑤HF中,由极性键形成的非极性分子有 ,由非极性键形成的非极性分子有 ,能形成分子晶体的物质是 ,含有氢键的晶体的化学式是 ,属于离子晶体的是 ,属于原子晶体的是 .(填序号)
(3)如图表示一些晶体的结构中的某一部分.
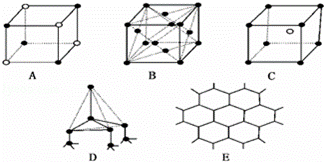
①代表金刚石的是(填编号字母,下同) ,其中每个碳原子与 个碳原子最接近且距离相等.
②代表NaCl的是 ,每个Na+周围与它最接近且距离相等的Na+有 个.
③代表CsCl的是 ,每个Cs+与 个Cl﹣紧邻.
④代表干冰的是 ,每个CO2分子与 个CO2分子紧邻.
⑤代表石墨的是 ,它属于 晶体.
考点:
晶胞的计算;共价键的形成及共价键的主要类型;晶体的类型与物质熔点、硬度、导电性等的关系;不同晶体的结构微粒及微粒间作用力的区别.
专题:
化学键与晶体结构.
分析:
(1)熔点高低顺序为:原子晶体>离子晶体>金属晶体>分子晶体,分子晶体中,其熔点与相对分子质量成正比,原子晶体熔点高低与其原子半径成反比;分子晶体熔化时不需破坏化学键,原子晶体熔化时只需破坏共价键;
(2)同种非金属元素之间形成非极性键,不同非金属元素之间易形成极性键,分子中正负电荷重心重合的分子为非极性键分子,正负电荷重心不重合的分子为非极性分子;由离子构成的晶体为离子晶体,由分子构成的晶体为分子晶体,由原子构成的晶体属于原子晶体;
(3)①金刚石中每个碳原子和其余四个原子形成正四面体结构;
②NaCl属于离子晶体,其阴阳离子配位数是6;
③CsCl属于离子晶体,其阴阳离子配位数是8;
④干冰属于分子晶体,根据晶胞结构判断;
⑤石墨晶体中,每一层中每个C原子和相邻3个C原子相连,层和层之间存在分子间作用力.
解答:
解:(1)晶体熔点高低顺序是:原子晶体>离子晶体>金属晶体>分子晶体,分子晶体的熔点与其相对分子质量成正比,二氧化碳属于分子晶体、NaCl属于离子晶体、Na属于金属晶体、Si属于原子晶体、二硫化碳属于分子晶体、金刚石属于原子晶体,原子晶体的熔点与其原子半径成反比,所以它们的熔点从低到高顺序是 ①<⑤<③<②<④<⑥;
分子晶体熔化时不需破坏化学键,所以熔化时不需破坏化学键①⑤,原子晶体熔化时只需破坏共价键,熔化时只需破坏共价键的是④⑥;
故答案为:①<⑤<③<②<④<⑥;①⑤;④⑥;
(2)①H2中只存在非极性键,属于非极性分子,为分子晶体;
②(NH4)2SO4中存在离子键、极性键,为离子晶体;
③SiC中只存在极性键,为原子晶体;
④CO2中只存在极性键,属于非极性分子,为分子晶体;
⑤HF中只存在极性键,属于极性分子,为分子晶体,还含有氢键,
所以由极性键形成的非极性分子有④,由非极性键形成的非极性分子有①,能形成分子晶体的物质是①④⑤,含有氢键的晶体的化学式是⑤,属于离子晶体的是②,属于原子晶体的是③;
故答案为:④;①;①④⑤;⑤;②;③;
(3)①金刚石中每个碳原子和其余四个原子形成正四面体结构,代表金刚石的是D,故答案为:D;4;
②NaCl属于离子晶体,其阴阳离子配位数是6,A代表氯化钠,每个Na+周围与它最接近且距离相等的Na+有12,故答案为:A;12;
③CsCl属于离子晶体,其阴阳离子配位数是8,代表CsCl的是C,根据图片知,每个Cs+与8个Cl﹣紧邻,故答案为:C;8;
④干冰属于分子晶体,代表干冰的是B,每个CO2分子紧邻的CO2分子个数=3×8×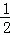 =12,故答案为:B;12;
=12,故答案为:B;12;
⑤石墨晶体中,每一层中每个C原子和相邻3个C原子相连,层和层之间存在分子间作用力,代表石墨的是E,属于混合晶体,故答案为:E;混合晶体.
点评:
本题考查物质结构和性质,从晶胞的计算、熔点高低判断、晶体类型的判断方面考查,熟练掌握典型晶体结构,会根据物质构成微粒判断晶体类型,难点是配位数的计算,题目难度中等.


科目:高中化学 来源: 题型:
对2SO2+O2⇌2SO3的反应.如果在密闭容器中进行,下列说法错误的是( )
|
| A. | 使用催化剂是为了加快反应速率,提高生产效率 |
|
| B. | 在上述条件下,SO2不可能100%地转化为SO3 |
|
| C. | 达到平衡时,SO2的浓度与SO3的浓度相等 |
|
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )
|
| A. | 电池工作时,锌失去电子 |
|
| B. | MnO2为该电池的负极 |
|
| C. | 正极反应为:Zn﹣2e﹣=Zn2+ |
|
| D. | 该电池放电时化学能转换为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能成功的是( )
|
| A. | 将乙酸和乙醇混合加热制乙酸乙酯 |
|
| B. | 苯和稀硝酸反应制硝基苯 |
|
| C. | CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀 |
|
| D. | 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛溶液,加热煮沸观察红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式书写正确的是( )
|
| A. | NaHCO3=Na++H++CO32﹣ | B. | HF⇌H++F﹣ |
|
| C. | H2CO3⇌2H++CO32﹣ | D. | CH3COONH4⇌CH3COO﹣+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
今有①盐酸、②醋酸、③硫酸三种稀溶液,用序号回答下列问题.
(1)若三种酸的物质的量浓度相等.
a.三种溶液中的c(H+)大小关系为 .
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH体积大小关系为 .
(2)若三种酸溶液中的c(H+)相等.
a.三种酸的物质的量浓度大小关系为 .
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
CH3COONa溶液中存在水解平衡:CH3COO-+H2OCH3COOH+OH-,下列说法正确的是 ( )。
A.加入少量NaOH固体,c(CH3COO-)减小
B.加入少量FeCl3固体,c(CH3COO-)减小
C.稀释溶液,溶液的pH增大
D.加入适量的醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+) > c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com