
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
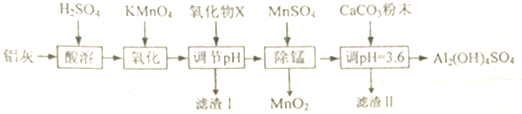
分析 Al2O3、FeO、Fe203和与硫酸反应,而二氧化硅与硫酸不反应,加入高锰酸钾是将亚铁氧化成铁离子,可以加入氧化铝或者氢氧化铝来调节溶液的PH,但是氧化物所以是氧化铝,使铁离子完全沉淀,加入硫酸锰还原高锰酸根离子,然后加入碳酸钙调节溶液的PH,从而使碱式硫酸铝[Al2(OH)4SO4]析出,由此分析解答.
(1)X为氧化铝,滤渣I的主要成分是二氧化硅和氢氧化铁,MnS04在“除锰”中的作用是还原剂;
(2)铁离子的检验加入硫氰化钾,观察溶液是否呈血红色;
(3)第一次调节pH使铁离子沉淀而铝离子不能沉淀,所以范围为:[2.8,3.4),第二次调节pH时,若溶液的pH偏高,碱性增加,溶液中的铝离子转化成偏铝酸根离子;(4)加入CaC03制备碱式硫酸铝的化学方程式为 Al2(SO4)3+2CaC03+2H2O=Al2(OH)4SO4+2CaSO4+2C02↑.
解答 解:Al2O3、FeO、Fe203和与硫酸反应,而二氧化硅与硫酸不反应,加入高锰酸钾是将亚铁氧化成铁离子,可以加入氧化铝或者氢氧化铝来调节溶液的PH,但是氧化物所以是氧化铝,使铁离子完全沉淀,加入硫酸锰还原高锰酸根离子,然后加入碳酸钙调节溶液的PH,从而使碱式硫酸铝[Al2(OH)4SO4]析出,
(1)X为氧化铝,滤渣I的主要成分是二氧化硅和氢氧化铁,MnS04在“除锰”中的作用是还原剂,故答案为:氧化铝;二氧化硅和氢氧化铁;还原剂;
(2)铁离子的检验加入硫氰化钾,观察溶液是否呈血红色,操作是取第一次调节PH后的清液于试管中,滴加硫氰化钾溶液,若溶液呈血红色,说明沉淀不完全,反之沉淀完全,故答案为:取第一次调节PH后的清液于试管中,滴加硫氰化钾溶液,若溶液呈血红色,说明沉淀不完全,反之沉淀完全;
(3)第一次调节pH使铁离子沉淀而铝离子不能沉淀,所以范围为:[2.8,3.4),第二次调节pH时,若溶液的pH偏高,碱性增加,溶液中的铝离子转化成偏铝酸根离子,故答案为:[2.8,3.4),溶液中铝元素的含量降低;
(4)加入CaC03制备碱式硫酸铝的化学方程式为 Al2(SO4)3+2CaC03+2H2O=Al2(OH)4SO4+2CaSO4+2C02↑,故答案为:Al2(SO4)3+2CaC03+2H2O=Al2(OH)4SO4+2CaSO4+2C02↑.
点评 本题考查了物质的制备原理,明确物质的性质是解本题关键,会从整体上分析每一步发生的反应及基本操作,知道加入物质的用途,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 4Fe2++2I-+3Cl2═4Fe3++I2+6Cl- | |
| B. | 2I-+Cl2═2Cl-+I2 | |
| C. | 2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 2Fe2++2I-+2Br-+3Cl2═2Fe3++I2+Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Fe2+、Na+、Ba2+、Al3+ |
| 阴离子 | Cl-、SO42-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取无水MgCl2,将MgCl2溶液直接蒸干 | |
| B. | 除去CuCl2溶液中含有的少量FeCl2,向溶液中加入过量CuO,待充分反应后过滤 | |
| C. | 的检验:取少量试样于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,则试样中含有 | |
| D. | 探究反应的限度:将1mL0.1mol•L-1的KI溶液与5mL0.1mol•L-1的FeCl2溶液混合,待充分反应后,滴加KSCN溶液,观察实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氟原子的结构示意图: | B. | 塑料王聚四氟乙烯的结构简式: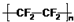 | ||
| C. | 中子数为10的氟原子:${\;}_{9}^{19}$F | D. | 萤石主要成分CaF2电子式: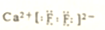 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,加水稀释0.01mol•L-1的氨水,c(NH4+)•c(OH-)逐渐增大 | |
| B. | 在H2SO3溶液中滴加少量NaClO溶液,c(SO32-)逐渐增大 | |
| C. | 在H2S溶液中滴加CuSO4溶液,H2S的电离程度逐渐增大 | |
| D. | 微热醋酸溶液,$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
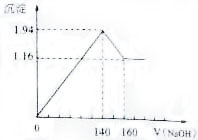 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为0.5 mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:(1)合金中Mg,Al的质量;
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为0.5 mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:(1)合金中Mg,Al的质量;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易溶于水 | B. | 难溶于水 | C. | 属于硅酸盐 | D. | 有颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:B>C>D>A | |
| B. | 氢化物的稳定性:C>D | |
| C. | A与C形成的化合物溶于水所得溶液显碱性 | |
| D. | B与D形成的化合物溶于水所得溶液显酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com