
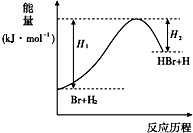
| A. | 正反应为放热反应 | |
| B. | 反应物总能量高于生成物总能量 | |
| C. | 升高温度可增大正反应速率,降低逆反应速率 | |
| D. | 加入催化剂,该化学反应的反应物的总能量与生成物的总能量差不改变 |
分析 A.图象中反应物和生成物的能量大小比较,反应物能量低于生成物能量;
B.依据图象中反应物和生成物的能量大小比较分析判断;
C.催化剂同等程度影响正逆反应速率;
D.加入催化剂能降低反应的活化能,催化剂不改变反应物总能量与生成物总能量之差即反应热不变.
解答 解:A.反应物的能量小于生成物的能量,反应是吸热反应,故A错误;
B.图象可知反应物的能量小于生成物的能量,反应是吸热反应,故B错误;
C.催化剂同等程度影响正逆反应速率,正逆反应速率增大,故C错误;
D.加入催化剂能降低反应的活化能,但反应热不变,故D正确;
故选D.
点评 本题考查了化学反应能量变化、催化剂的作用分析,题目难度不大,解答该题关键要理解催化剂概念中的“一变、二不变”的涵义.一变是反应速度变,二不变是本身质量和化学性质.


科目:高中化学 来源: 题型:选择题
| A. | 将滴管伸入试剂瓶中,然后用手指头捏紧橡胶乳头,赶走滴管中的空气 | |
| B. | 向烧杯内滴加试剂时,将滴管悬空放在烧杯上方,将试剂滴下 | |
| C. | 取液后的滴管保持橡胶乳头在上,不可倒置或平放 | |
| D. | 除滴瓶上的滴管外,用过的滴管应立即用清水冲洗干净 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.15mol/L | D. | 0.05mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com