
根据原子结构及元素周期律的知识,下列叙述正确的是
A.由于相对分子质量:HCl>HF,故沸点:HCl>HF
B.硅处于金属与非金属的过渡位置,硅可用作半导体材料
C.由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在
D.Cl-、S2-、Ca2+、K+半径逐渐减小
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:填空题
(13分)铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题。
(1)工业上可用Cu2S+O2 2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃-60℃,加入H2O2,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:________________.CuSO4 溶液中加入一定量的Na2SO3溶液和NaCI溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________________________。
溶液中加入一定量的Na2SO3溶液和NaCI溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________________________。
(3)电子工业常用30%的FeCl3溶液腐蚀附在绝缘板上的铜箔制造印刷电路板,取其腐蚀后的废液,加入一定量的铁粉后,若无固体剩余,则反应后的溶液中肯定有的离子是________________;若有红色固体,则反应后的溶液中肯定没有的离子是________,检验该离子的试剂为________。
(4)铁氰化钾 K3[Fe(CN)5]和亚铁氰化钾K4[Fe(CN)6] 的混合溶液可用于太阳能电池的电解液,该太阳能电池的工作原理示意图如图所示,其中催化剂a为________极,电极反应式为________;

查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:填空题
(14分)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
a、写出由磷酸钙矿制取白磷总的反应方程式_____________________________。
b、上述反应中SiO2起何作用?______________________________________。
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间(已知磷酸的各级电离常数为:K1= 7.1×103 K2 = 6.3×108 K3 =4.2×1013 lg7.1≈0.9 lg6.3≈0.8 lg≈0.6) 。Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省仙桃天门潜江高三上学期期末联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.水的离子积KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4C1晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的比值增大
D.室温下,CH3COOH的 ,NH3·H2O的
,NH3·H2O的 ,CH3COOH溶液中的c (H+)与NH3·H2O中的c(OH-)相等
,CH3COOH溶液中的c (H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:填空题
(15分)氨基甲酸铵(H2NCOONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下方法制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) H2NCOONH4(s) ΔH<0
H2NCOONH4(s) ΔH<0
(1)实验室通常采用图1装置制取氨气,你所选择的试剂是 。
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是 。
液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法 (填操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图3所示。能否将浓H2SO4改为稀H2SO4 (填“能”或“否”),理由是 。

(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000 g。则样品中氨基甲酸铵的质量分数为_______。
[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(CaCO3)=100]
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高一上学期期末考试化学试卷(解析版) 题型:计算题
将20g某铁矿石(设只含铁的氧化物和杂质SiO2)溶于过量的稀盐酸,过滤后得滤液和5.6g不溶物;然后在滤液中加入足量的NaOH溶液,过滤后将沉淀灼烧,得16g红棕色固体。
(1)红棕色固体的化学式是 ,其中的n(Fe)= mol。
(2)请计算(写出计算过程):
①该矿石中铁氧化物的化学式。
②若加入的稀盐酸为4.0mol·L -1200mL,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.澄清的石灰水跟盐酸反应:H++OH-== H2O
B.铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑
C.NaHCO3溶液与NaOH溶液反应: OH-+ HCO3-=CO32-+ H2O
D.金属钠跟水反应: Na+2H2O ==Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:填空题
(11分)甲醇可作电池的原料,也会造成环境污染。请根据有关反应回答问题。
(1)以CH4和H2O为原料,通过下列反应可制备甲醇。
①CH4(g)+H2O(g) CO(g)+3H2(g) △H =+206.0 kJ·mol-1
②CO(g)+2H2(g) CH3OH (g) △H=-129.0 kJ·mol-1
则CH4(g)+H2O(g) CH3OH (g)+H2(g)的△H= kJ·mol-1。
(2)将1.0 mol CH4(g)和2.0 mol H2O(g)通入容积为10 L的容器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。设100℃时达到平衡所需的时间为5 min,
则这时间段v(H2)= mol·L-1·min-1。

(3)在一定温度下,将一定量CO和H2充入密闭容器发生反应②。达到平衡后,若压缩容器体积至原来的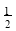 ,对平衡体系产生的影响是 (填序号)。
,对平衡体系产生的影响是 (填序号)。
①c ( H2 )减小 ②CH3OH 的物质的量增加 ③新平衡时, 减小,
减小,
④正反应速率加快,逆反应速率减慢 ⑤平衡常数K增大
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,则:

①Co2+在阳极的电极反应式为 ;
②请完成除去甲醇的离子方程式:Co3++CH3OH+ = Co2++CO2↑+6H+
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市五校高二上学期期末联考化学试卷(解析版) 题型:填空题
(14)CO2是最重要温室气体,如何降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.5 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。

①写出该反应的化学方程式_______________________计算从反应开始到3 min时,氢气的平均反应速率v(H2)=____________________。
②下列措施中一定能使CO2的转化率增大的是___________________ 。(双选、填序号)
A.在原容器中再充入1 mol H2 B.在原容器中再充入1 mol CO2
C.缩小容器的容积 D.使用更有效的催化剂
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。

①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则该反应的反应热a值____(填“增大”、“减小”或“不变”)。
在一定温度下,增大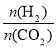 的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com