
| A. | 氯化钠的电离是指在电流作用下离解成钠离子和氯离子 | |
| B. | 溶于水后能电离出氢离子的化合物都是酸 | |
| C. | 硫酸钡难溶于水,所以硫酸钡属于弱电解质 | |
| D. | 醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,故醋酸是弱电解质 |
分析 A.氯化钠在水溶液中电离时,是在水分子作用下电离出阴阳离子;
B.溶于水后电离出的阳离子全部是氢离子的化合物是酸;
C.硫酸钡难溶于水,但溶于水的硫酸钡完全电离;
D.部分电离的电解质是弱电解质.
解答 解:A.氯化钠在水溶液中电离时,是在水分子作用下电离出阴阳离子,不需要电流作用,故A错误;
B.溶于水后电离出的阳离子全部是氢离子的化合物是酸,溶于水后能电离出氢离子的化合物可能是盐,如NaHSO4,故B错误;
C.硫酸钡难溶于水,但溶于水的硫酸钡完全电离,所以硫酸钡是强电解质,故C错误;
D.部分电离的电解质是弱电解质,醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,说明醋酸部分电离,故醋酸是弱电解质,故D正确;
故选D.
点评 本题考查电解质的电离、强弱电解质判断、酸碱盐的判断等知识点,为高频考点,侧重考查基本概念,明确概念内涵是解本题关键,注意不能根据溶解性判断电解质强弱,要根据其电离程度判断,题目难度不大.


科目:高中化学 来源: 题型:填空题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 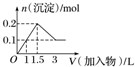 向1L浓度均为0.1 mol•L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol•L-1的稀H2SO4 | |
| B. | 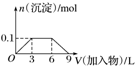 向1L浓度分别为0.1 mol•L-1和0.3 mol•L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol•L-1的稀NaOH溶液 | |
| C. | 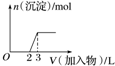 向烧碱溶液中滴加明矾溶液 | |
| D. | 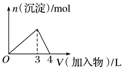 向AlCl3溶液中滴加过量氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
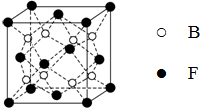 已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.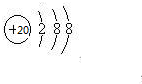 ,X的化学式Na3AlF6.
,X的化学式Na3AlF6.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
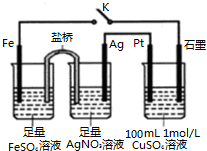
| A. | 盐桥中的电解质不可以用KCl | |
| B. | 闭合K,Pt电极上发生的反应为:4OH--4e-═O2↑+2H2O | |
| C. | 导线中流过0.5mol e-时,加入12.4g CuCO3,CuSO4溶液可恢复原组成 | |
| D. | 闭合K,整个电路中电流的流向为:Ag电极→Pt电极→石墨电极→Fe电极→Ag电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
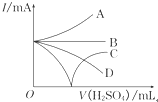 向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com