
在N2(g)+3H2(g)  2NH3(g)反应中,表示该反应速率最快的是
2NH3(g)反应中,表示该反应速率最快的是
A.v(N2)=0.1 mol·L-1·s-1 B.v(H2)=0.9 mol·L-1·s-1
C.v(NH3)=0.8 mol·L-1·s-1 D.v(N2)=1 mol·L-1·min-1
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2014-2015湖北省咸宁市高二上学期期末考试化学(B)试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
A.工业制取金属钾:Na(l)+ KCl(l) NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
B.配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释
C.向氯水中加CaCO3后,溶液漂白性增强
D.二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省邯郸市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列关于铁及其化合物的说法中正确的是
A.Fe3O4是一种红棕色粉末,俗称磁性氧化铁
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.去除FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤
D.Fe3+与KSCN反应产生红色沉淀
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子一定能大量共存的是
A.在由水电离出的C(H+)=10-13 mol·L-1的溶液中:NH4+、Na+、Cl-、AlO2-
B.在强碱性溶液中:Na+、K+、CO32-、NO3-
C.在pH=12的溶液中:NH4+、Na+、SO42-、Cl-
D.在C(H+)=0.1 mol·L-1的溶液中:K+、I-、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
对于温度与反应方向的关系,下列判断正确的是
A.ΔH<0,ΔS>0,所有温度下反应都自发进行
B.ΔH>0,ΔS>0,所有温度下反应都自发进行
C.ΔH<0,ΔS<0,高温下反应自发进行
D.ΔH>0,ΔS<0,所有温度下反应都自发进行
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省湛江市高一上学期期末考试化学试卷(解析版) 题型:计算题
计算:(6分)用32g Cu与足量的浓硫酸反应制取SO2气体,反应方程式为:Cu + 2H2SO4(浓) CuSO4 + SO2↑+2H2O
CuSO4 + SO2↑+2H2O
(1)生成的SO2在标准状况下的体积是多少?
(2)该反应中做氧化剂的H2SO4的物质的量为多少?
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省湛江市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列四种物质,不能由金属与非金属两种单质直接化合生成的是
A.FeCl2 B.Na2O2 C.FeI3 D.CuCl2
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省湛江市高二第一学期期末化学试卷(解析版) 题型:填空题
(13分) (1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s) + O3(g) = 3Ag2O(s) ΔH1
已知2Ag2O(s) = 4Ag(s) + O2(g) ΔH2
则常温下反应: 2O3(g) = 3O2(g)的ΔH= (用ΔH1和ΔH2表示).
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应:
CH4(g) +2NO2(g) N2(g) +CO2(g) +2H2O(g)
N2(g) +CO2(g) +2H2O(g)
在不同温度、不同投料比时,NO2的平衡转化率见下表:
投料比[n(NO2) / n(CH4)] | 400 K | 500 K | 600 K |
1 | 60% | 43% | 28% |
2 | 45% | 33% | 20% |
①写出该反应平衡常数的表达式K = 。
②若温度不变,提高[n(NO2) / n(CH4)]投料比,则NO2的平衡转化率 。(填“增大”、“减小”或“不变”。)
③由上表可知该可逆反应的正反应是 反应。
④400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数 。
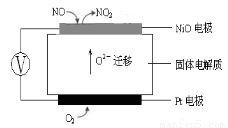
(3)下图为连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图。则NiO电极上NO发生的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省龙岩市非一级达标校高一上学期期末化学试卷(解析版) 题型:填空题
(12分)Fe、Ca是重要的金属元素。运用所学知识,回答下列问题。
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式: ;
(2)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,该现象说明该溶液中含有的离子是 ;
②验证该溶液中含有Fe2+,正确的实验方法是 ;
A.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
B.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
C.观察溶液是否呈浅绿色
(3)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3~2.7×10-3 mol·L-1。现抽取某人血样10ml。稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3 mol·L-1KMnO4溶液与溶解得到的草酸恰好完全反应。据此可求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常。
(提示2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O)
①配制5.0×10-3 mol·L-1 KMnO4 200mL溶液,需要称取KMnO4固体的质量是 g;
②每消耗草酸0.5mol,转移电子的物质的量为 mol;
③此人血液中的Ca2+的浓度为 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com