把氯气通入稀氨水中,NH
3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到联氨(N
2H
4).联氨是一种可燃性液体,可用作火箭燃料.
(1)火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热.已知:12.8g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量;且H
2O(l)═H
2O(g)△H=+44kJ?mol
-1,写出液态联氨与足量过氧化氢反应生成氮气和液态水的热化学方程式:
.
(2)如图1所示是一个电化学过程示意图.
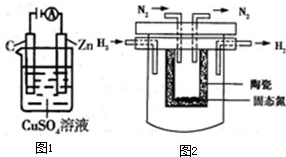
①锌片上发生的电极反应是
.
②假设使用肼-空气燃料电池作为本过程中的电源,锌电极的质量变化是128g,则肼-空气燃料电池理论上消耗标准状况下的空气
L(假设空气中氧气体积含量为20%).
(3)传统制备肼的方法是以NaClO氧化NH
3,制得肼的稀溶液.该反应的离子方程式是
.
(4)1998年希腊亚里士多德大学的Mamellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H
+),实现了高温常压下高转化率的电解法合成氨,其实验装置如图2所示,该装置中阳极可以产生H
+,则阴极的电极反应式为
.

![]() ZnO+H2O
ZnO+H2O![]() O2+H2O+2e-
O2+H2O+2e-![]() 2OH-
2OH-