
 2009年10月15日新华社报道:全国农村应当在“绿色生态•美丽多彩•低碳节能•循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
2009年10月15日新华社报道:全国农村应当在“绿色生态•美丽多彩•低碳节能•循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:分析 (1)依据化学方程式和盖斯定律计算得到;
(2)①平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;反应是吸热反应,温度升高平衡正向进行,平衡常数增大;
②依据浓度商和平衡常数比较判断平衡移动的方向;
(3)①依据图象分析,达到平衡时物质的浓度变化,结合反应速率概念计算得到;
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.依据平衡移动方向分析判断$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$变化;
A.升高温度平衡逆向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$减小;
B.再充入H2 平衡正向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$增大;
C.再充入CO2 平衡正向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$减小;
D.将H2O(g)从体系中分离平衡正向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$增大;
E.充入He(g),使体系压强增大,分压不变,平衡不动,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$不变;
(4)根据△G的大小判断反应能否进行.
解答 解:(1)①C(s)+1/2O2(g)=CO(g)△H=-126.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
③H2O(g)=H2O(l)△H=-44kJ•mol-1
依据盖斯定律①-$\frac{②}{2}$+③得到C(s)+H2O(g)=CO(g)+H2(g)△H=+115.4 kJ•mol-1;
则在25℃,101kPa时:C(s)+H2O(g)=CO(g)+H2(g)△H=+115.4 kJ•mol-1;
故答案为:+115.4 kJ•mol-1;
(2)①FeO(s)+CO(g)?Fe(s)+CO2(g),反应的平衡常数K=$\frac{c(C{O}_{2})}{c(CO)}$,FeO(s)+CO(g)=Fe(s)+CO2(g)△H>0,温度升高,化学平衡移动后达到新的平衡,平衡正向进行,平衡常数增大,
故答案为:$\frac{c(C{O}_{2})}{c(CO)}$;增大;
②1100℃时测得高炉中,c(CO2)=0.025mol•L-1,c(CO)=0.1mol•L-1,则在这种情况下,Qc=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{0.025mol/L}{0.1mol/L}$=0.25<K=0.263;反应未达到平衡,正向进行,
故答案为:否;因为Qc=$\frac{c(C{O}_{2})}{c(CO)}$=0.25<K=0.263;
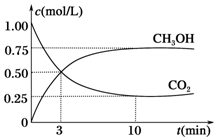
(3)①②CO2(g)+3H2(g)?CH3OH(g)+H2O(g),依据图象分析达到平衡后,c(CH3OH)=0.75mol/L,c(CO2)=0.25mol/L,反应消耗的氢气浓度c(H2)=2.25mol/L,氢气的平均反应速率v(H2)=$\frac{2.25mol/L}{10min}$=0.225 mol/(L•min),
故答案为:0.225 mol/(L•min);
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.依据平衡移动方向分析判断$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$变化;
A.升高温度平衡逆向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$减小;
B.再充入H2 平衡正向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$增大;
C.再充入CO2 平衡正向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$减小;
D.将H2O(g)从体系中分离平衡正向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$增大;
E.充入He(g),使体系压强增大,分压不变,平衡不动,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$不变;
故答案为:BD;
(4)反应2CO=2C+O2(△H>0、△S<0),则△G=△H-T•△S>0,反应是一个焓增、熵减的反应,任何情况下不能自发进行;
故答案为:否,该反应是一个焓增、熵减的反应,任何情况下不能自发进行.
点评 本题考查了热化学方程式和盖斯定律的计算应用,平衡盘点和平衡常数的计算应用,反应速率图象分析判断,影响平衡因素的分析应用,题目难度中等.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
 氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
氯及其化合物在生产、生活中有广泛的用途.回答下列问题:| 容器编号 | 温度/ | 容器体积/L | ClO2(g)的平衡转化率 |
| a | T1 | V1=1L | 75% |
| b | T2 | V2 | |
| c | T3 | V3 | 75% |
| d | |||
| e |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
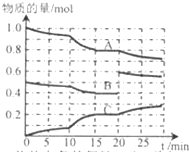 在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液:HCO3-+H2O?CO32-+H3O+ | |
| B. | NaHS溶液:HS-+H2O?H2S+OH- | |
| C. | 硫酸铝溶液跟碳酸氢钠溶液反应:Al3++3HCO3-+6H2O?Al(OH)3↓+3CO2↑ | |
| D. | NH4Cl溶于D2O中:NH4++D2O?NH3HDO+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NO3-、Cl- | B. | Cu2+、K+、NO3- | C. | H+、HCO3-、NO3- | D. | Na+、Ba2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
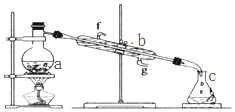 掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com