
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是 ( )
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.  H2SO4(aq)+
H2SO4(aq)+ Ba(OH)2(aq)=
Ba(OH)2(aq)=  BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
放热反应CO(g)+H2O(g) CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则 ( )
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则 ( )
A.K2和K1的单位均为 mol·L-1
B.K2>K1
C.c2(CO)=c2(H2O)
D.c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:选择题
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔融) 4Na+O2↑+2H2O;后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH
4Na+O2↑+2H2O;后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH 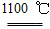 Fe3O4+2H2↑+4Na↑。下列有关说法正确的是 ( )
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是 ( )
A.电解熔融氢氧化钠制钠,阳极发生的电极反应为2OH--2e-=H2↑+O2↑
B.若用戴维法与吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
C.吕萨克法制钠的原理是利用铁的还原性比钠强
D.目前工业上常用电解熔融氯化钠法制钠(如下图),电解槽中石墨为阳极,铁为阴极
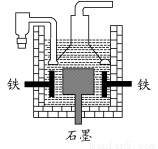
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:选择题
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的ΔH表示生成1 mol产物的数据。已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是( )
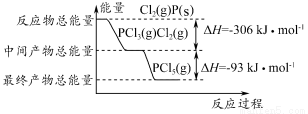
A.其他条件不变,升高温度有利于PCl5的生成
B.反应2P(s)+5Cl2(g)=2PCl5(g)对应的反应热 ΔH=-798 kJ·mol-1
C.P和Cl2反应生成PCl3的热化学方程式为2P(s)+3Cl2(g)=2PCl3(g) ΔH=-306 kJ·mol-1
D.其他条件不变,对于PCl5分解生成PCl3和Cl2的反应,增大压强,PCl5的转化率减小,平衡常数K不变
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:填空题
现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素的性质或原子结构 |
X | 最外层电子数是次外层电子数的3倍 |
Y | 常温下单质是双原子分子,其氢化物的水溶液显碱性 |
Z | 第三周期元素的简单离子中半径最小 |
(1)元素X的一种单质在生活中常用作饮水机的消毒剂,该单质的化学式是 ,元素Z的离子结构示意图为 。
(2)元素Y与氢元素形成一种离子YH4+,请写出检验溶液中存在该离子的实验操作、现象和结论 。
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式: 。
(4)元素X与元素Y相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.Y的氢化物可在纯X2中燃烧生成X的氢化物和Y2
b.X的单质比Y的单质更容易与H2化合
c.X与Y形成的化合物中Y元素呈正价态
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
短周期元素A、B、C、D在周期表中所处的位置如图所示。A、B、C、D四种元素的质子数之和为36。E元素原子的半径在同周期中最大,且E的离子与C的离子具有相同的电子层结构。则下列说法正确的是( )
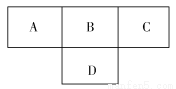
A.元素A形成的气态氢化物一定是正四面体形分子
B.五种元素形成的氢化物中,C的氢化物的沸点最高
C.A、C两种元素可形成A3C2型化合物,该化合物在空气中不能燃烧
D.B、C、D、E四种元素的离子半径由大到小的顺序为D>B>C>E
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:选择题
A和B是短周期元素,A2-与B+的核外电子总数之差为8,则下列说法正确的是( )
A.A和B的原子序数之差为8
B.A和B原子的最外层电子数之和为8
C.A和B原子的最外层电子数之差为7
D.A和B原子的核外电子数总和可能为11
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷(解析版) 题型:填空题
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。回答下列问题:
(1)单质铝溶于过量氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式: 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com