
| A. | 使用适当的催化剂只改变正反应速率 | |
| B. | 降低压强能提高逆反应速率 | |
| C. | 升高温度能同时提高正、逆反应速率 | |
| D. | 减小压强对正反应速率影响小于逆反应速率的影响 |
科目:高中化学 来源: 题型:解答题
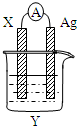 依据氧化还原反应2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.回答下列问题.
依据氧化还原反应2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
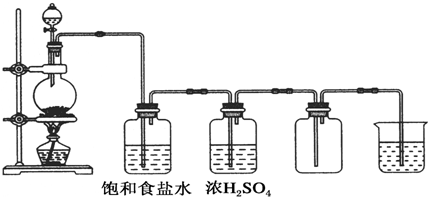
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应. ,C的分子式C2H5Cl,D的结构简式CH3CH2OH.
,C的分子式C2H5Cl,D的结构简式CH3CH2OH. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入3滴 1mol/LFeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增多. |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2 溶液 | 两支试管中均未明显见到有 气泡产生. |
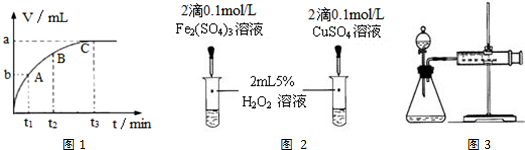
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 氢气和氯气光照下生成氯化氢 | |
| C. | 乙炔和氢气在催化剂下合成乙烷 | |
| D. | 乙烷和氯气光照下生成多氯代物和氯化氢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com