
下列实验操作方法正确的是
A.欲除去乙烷中混有的乙烯可选用酸性KMnO4溶液洗气
B.使用萃取的方法可提纯粗苯甲酸
C.欲区分苯和甲苯,分别取少量样品价足量KMnO4溶液,振荡,KMnO4溶液褪色为甲苯,反之为苯
D.欲确定溴乙烷中含有溴原子,加入适量NaOH溶液后加热,待溶液冷却后滴加AgNO3溶液,若生成淡黄色沉淀即可确定
科目:高中化学 来源:2016-2017学年山西省高二上开学考化学试卷(解析版) 题型:选择题
下列有关物质结构的说法正确的是
A.78g Na2O2晶体中所含阴、阳离子个数共为4NA
B.HBr的电子式为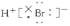
C.3.4g氨气中含有0.6NA个N——H键
D.PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期周考(8.28)化学试卷(解析版) 题型:选择题
已知NO2与NaOH溶液反应为:3NO2+2NaOH=2NaNO3+NO+H2O;NO、NO2可一起与NaOH溶液作用:NO+NO2+2NaOH=2NaNO2+H2O。在盛a molNO、b molNO2和c molO2的密闭容器中,加入V L某浓度的烧碱溶液后,密闭容器中压强几乎为零。则NaOH溶液的物质的量浓度(mol/L)为( )
A. B.
B. C.
C. D.
D.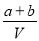
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期周考(8.28)化学试卷(解析版) 题型:选择题
下列离子方程式正确的是()
A.向Ba(OH)2溶液与稀H2SO4溶液发生中和反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.H2S通入FeCl3溶液中:2Fe3++S2-=2Fe2++S↓
C.碳酸氢钠溶液与硫酸氢钠溶液反应:H++HCO3-=CO2↑+H2O
D.向漂白粉溶液中通入SO2: Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上学期开学考试化学试卷(解析版) 题型:选择题
第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0。01mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
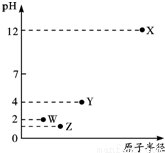
A.气态氢化物的稳定性:Z>W>Y
B.简单离子半径:Z<W
C.Y元素存在同素异形体
D.X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上入学考试化学试卷(解析版) 题型:填空题
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
| X | Y | Z | M | R | Q |
原子半径 |
|
| 0.186 | 0.074 | 0.099 | 0.143 |
主要化合价 |
| -4,+4 |
| -2 | -1,+7 | +3 |
其他 | 阳离子无核外电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
|
|
|
(1)X和M的原子可构成 18 电子的分子,该分子的结构式为 。
(2)R元素的单质与水反应的离子方程式是 。
(3)Z与Q相比,金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (填字母序号)。
a.Q的熔点比Z的熔点高,Q的硬度比Z的硬度大
b.Z与冷水反应迅速,而Q与冷水几乎不反应
c.Z的最高价氧化物对应水化物是强碱,而Q的最高价氧化物对应水化物具有两性
(4)与Y元素同主族的短周期元素E在自然界中存在多种核素,它们之间的关系互为 ,其中用于测定一些文物年代的核素的符号为 。
(5)写出Z2M2与X2M反应的化学方程式并标出电子转移关系。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上入学考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 所含质子数和电子数相等的粒子一定是原子
B. 两种粒子如果核外电子排布相同,化学性质就一定相同
C. 质量数相同的原子其化学性质一定相同
D. 具有相同核电荷数的原子或简单的离子,一定是同种元素
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高一上入学考试化学卷(解析版) 题型:选择题
下列物质的用途与其物理性质有关的是
A.用白醋或稀盐酸洗去水壶或热水瓶胆上的水垢
B.用石墨作干电池的电极
C.做馒头时,在发酵后的面团中加入适量的纯碱,使蒸熟的馒头疏松多孔
D.用生石灰作方便面等包装食品的干燥剂
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三第一次月考理综化学试卷(解析版) 题型:填空题
氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。
(1)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
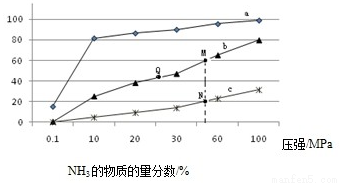
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③ M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
② NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
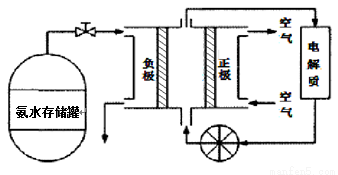
①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com