
【题目】标况下将8.96 L氯化氢气体溶于水形成100 mL溶液,然后与足量的铁屑反应。
(1)所得盐酸溶液的物质的量浓度是多少________?
(2)参加反应的铁的质量是多少________?
(3)标况下生成氢气的体积是多少________?
(4)将生成的氯化亚铁配成400 mL溶液,此溶液中氯化亚铁的物质的量浓度是多少________?
【答案】4 mol·L-1 11.2g 4.48L 0.5mol·L-1
【解析】
(1)n(HCl)=![]() =0.4mol,根据c(HCl)=
=0.4mol,根据c(HCl)=![]() 计算溶液物质的量浓度;
计算溶液物质的量浓度;
(2)根据盐酸和铁之间的关系式计算Fe的质量;
(3)足量Fe和稀盐酸反应生成氢气,根据H原子守恒计算生成氢气体积;
(4)根据Cl原子守恒计算FeCl2的物质的量,再根据c=![]() 计算溶液物质的量浓度;
计算溶液物质的量浓度;
(1)所得盐酸的物质的量浓度=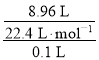 =4 mol·L-1,
=4 mol·L-1,
故答案为:4 mol·L-1;
(2)根据铁和盐酸反应的方程式:Fe+2HCl=FeCl2+H2↑,参加反应的铁的质量=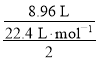 ×
×![]() =11.2 g,
=11.2 g,
故答案为:11.2g;
(3)根据H原子守恒,HCl中的H全部生成了氢气,所以标况下生成氢气的体积=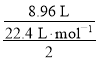 ×22.4 L·mol-1=4.48 L,
×22.4 L·mol-1=4.48 L,
故答案为:4.48L;
(4)氯化亚铁的物质的量和参加反应的铁的物质的量相等,所以氯化亚铁的物质的量浓度= =0.5 mol·L-1,
=0.5 mol·L-1,
故答案为:0.5mol·L-1。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法不正确的是( )
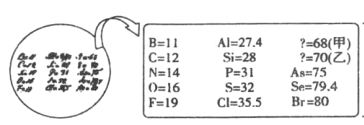
A.推测乙可以用作半导体材料
B.原子半径比较:甲>乙![]()
C.元素乙的简单气态氢化物的稳定性比![]() 弱
弱
D.元素甲的原子序数为21
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+CuB.3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C.AgNO3+NaCl=AgCl↓+NaNO3D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有物质的量浓度均为0.1mo/L的下列溶液:
(1)①NH3·H2O ②FeCl2 ③NaHSO4 ④KOH ⑤Ba(OH)2 ⑥H2SO4,其pH由大到小的顺序排列的是(填序号)___。
(2)写出氯化亚铁溶液中,亚铁离子水解的离子方程式___。
(3)写出硫酸氢钠与氢氧化钡2:1反应的离子方程式___。
(4)将氢氧化钾与氯化亚铁溶液混合,现象___。依次发生的化学方程式____、___。
(5)氯化亚铁保存时为何加少量铁粉___,若保存硫酸铁溶液时应向溶液中加入____。
(6)如何利用氯水和硫氰化钾检验氯化亚铁溶液中的Fe2+,写出加入试剂的先后顺序和对应现象__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示能量变化,分析下列说法正确的是

A.A(g)+B(g)→C(g)+D(l)是放热反应
B.A(g)+B(g)→C(g)+D(l)是吸热反应
C.C(g)+D(l)→A(g)+B(g)是放热反应
D.A(g)+B(g)具有的能量小于C(g)+D(l)具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
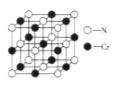
【题目】目前铬被广泛应用于冶金、化工、铸铁及高精端科技等领域。回答下列问题:
(1)基态Cr原子价层电子的轨道表达式为_______,其核外有_______种不同能量的电子。
(2)Cr的第二电能离(ICr)和Mn的第二电离能(IMn)分别为1590.6 kJ·mol-1、1509.0 kJ·mol-1,ICr > IMn的原因是____________。
(3)过氧化铬CrO5中Cr的化合价为+6,则该分子中![]() 键、
键、![]() 键的数目之比为______。
键的数目之比为______。
(4)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___________。
(5)Cr的一种配合物结构如图所示,该配合物中碳原子的杂化方式是_______,阳离子中Cr原子的配位数为_________,ClO![]() 的立体构型为________。
的立体构型为________。

(6)氮化铬晶体的晶胞结构如图所示,Cr处在N所围成的________空隙中,如果N与Cr核间距离为apm,则氮化铬的密度计算式为__________g·cm-3(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 KI可催化H2O2分解,机理为:①H2O2+I-→H2O+IO-;②H2O2+IO-→H2O+O2↑+I-。反应过程中能量变化如图所示,下列判断错误的是( )
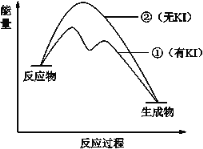
A.KI改变了反应的途径B.KI不能改变总反应的能量变化
C.H2O2+Iˉ→H2O+IOˉ是放热反应D.反应物总能量高于生成物总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
请回答下列问题。
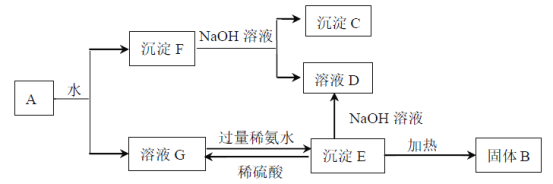
(1)图中涉及分离溶液与沉淀的方法是______________________________。
(2)B、C、D、E4种物质的化学式为:B___________、C___________、D___________、E___________。
(3)沉淀F与NaOH溶液反应的离子方程式为_________________________________。溶液G与过量稀氨水反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,3]己烷的结构为![]() ,已知环烷烃的碳原子数越少越容易开环加成。下列说法中正确的是( )
,已知环烷烃的碳原子数越少越容易开环加成。下列说法中正确的是( )
A.![]() 的名称为螺[4,3]辛烷
的名称为螺[4,3]辛烷
B.![]() 的所有碳原子处于一个平面
的所有碳原子处于一个平面
C.螺[2,3]己烷是己烯的同分异构体
D.螺[2,3]己烷加氢可能生成己烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com