
【题目】下列化学反应的离子方程式中正确的是( )
A. 盐酸与碳酸钡反应:CO32-+2H+ = CO2↑+H2O
B. 硫酸铜溶液中滴加氢氧化钡溶液:Ba2++SO42-= BaSO4↓
C. 澄清石灰水与少量小苏打溶液混合:Ca2+ + OH-+ HCO3-= CaCO3↓ + H2O
D. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
【答案】C
【解析】
A.因碳酸钙是难溶物,所以应写成化学式,正确的离子方程式是:CaCO3+2H+ = Ca2++CO2↑+H2O,故A错误;B. 硫酸铜溶液中滴加氢氧化钡溶液除了生成硫酸钡沉淀外还有氢氧化铜沉淀生成,正确的离子方程式是:Ba2++2OH-+Cu2++SO42-=Cu(OH)2↓+BaSO4↓,故B错误;C. 澄清石灰水与少量小苏打溶液混合时,按“谁少量谁的化学计量数是1”的方法,则离子方程式是:Ca2+ + OH-+ HCO3-= CaCO3↓ + H2O,故C正确;D. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体,因生成物是胶体而不是沉淀,故正确的离子方程式是:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,故D错误。此题答案选C
Fe(OH)3(胶体)+3H+,故D错误。此题答案选C


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】钴是一种中等活泼金属,化合价为+2价和+3价,其中CoC12易溶于水。某校同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。回答下列问题:
(1)甲同学用Co2O3与盐酸反应制备CoC124H2O,其实验装置如下:
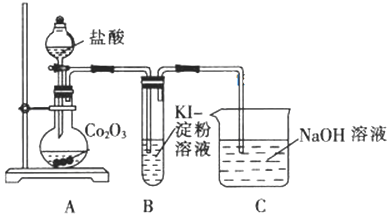
①烧瓶中发生反应的离子方程式为______。
②由烧瓶中的溶液制取干燥的CoC124H2O,还需经过的操作有蒸发浓缩、______、洗涤、干燥等。
(2)乙同学利用甲同学制得的CoC124H2O在醋酸氛围中制得无水(CH3COO)2Co,并利用下列装置检验(CH3COO)2Co在氮气气氛中的分解产物。已知PdC12溶液能被CO还原为Pd。
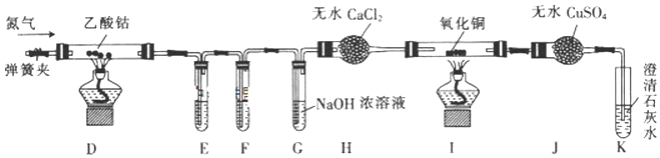
①装置E、F是用于检验CO和CO2的,其中盛放PdC12溶液的是装置______(填“E”或“F”)。
②装置G的作用是______;E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是______。
③通氮气的作用是______。
④实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是______。
⑤若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6,且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是
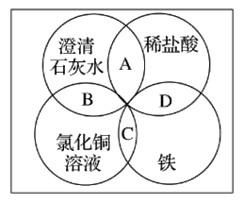
A. 复分解反应、复分解反应、化合反应、置换反应
B. 中和反应、置换反应、复分解反应、置换反应
C. 复分解反应、复分解反应、置换反应、置换反应
D. 分解反应、复分解反应、置换反应、置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的说法正确的是( )
A. 依据丁达尔效应可将分散系分为溶液、胶体与浊液
B. 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C. Na+、K+、SO42-、Br-能在Fe(OH)3胶体中大量共存
D. 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
A. Na的还原性强于金刚石B. 另一种化合物是NaCl
C. 纳米级金刚石粉末可以透过半透膜D. 这个反应是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1。
(2)向甲、乙两个均为1 L的密闭容器中,分别充入5 mol SO2和3 mol O2,发生反应:2SO2(g)+
O2(g)![]() 2SO3(g) ΔH<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5 mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6 mol。则T1___T2(填“>”、“<”),甲容器中反应的平衡常数K=_____________________。
2SO3(g) ΔH<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5 mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6 mol。则T1___T2(填“>”、“<”),甲容器中反应的平衡常数K=_____________________。
(3)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3 mol H2通过K1、K3充入A、B中,发生的反应为:N2(g)+3H2(g) ![]() 2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。
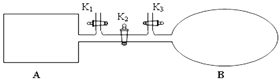
①下列示意图既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是______。
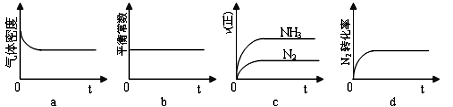
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率υ(H2)=___________________________。
(4)将0.1 mol氨气分别通入1 L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为____________(用“c1、c2、c3和>、<、=”表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,求该温度下NH4Cl的水解常数K h 为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 2.3gNa投入到97.7g水中形成溶液的质量分数为2.3%
B. 25g CuSO4.5H2O溶于水配成1L溶液,溶质的物质的量浓度为0.1mol/L
C. Na2O2溶于水后溶质未发生改变
D. 标准状况下,22.4 L的SO3中所含分子数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是
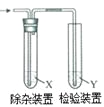
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中的信息判断,下列说法错误的是

A. 第①组反应的氧化产物为O2
B. 第②组反应中C12与FeBr2的物质的量之比小于或等于1:2
C. 第③组反应中生成3mol C12,转移6mol电子
D. 氧化性由强到弱的顺序为C1O3- >C12>Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com