
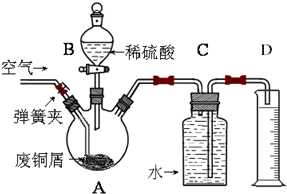
·ÖĪö Ļņ±ūÓėÅØŃĪĖį·“Ó¦ŗóµÄĀĖŅŗ£Ø¼ŁÉčŅŅČ«²æŅŻ³ö£©ÖŠ¼ÓČĖ×ćĮæµÄNaOHČÜŅŗ£¬ĻČ³öĻÖ°×É«³Įµķ£¬×īÖÕ×Ŗ±äĪŖŗģŗÖÉ«³Įµķ£¬ŌņĀĖŅŗÖŠŗ¬ÓŠŃĒĢśĄė×Ó£¬×ĘÉÕŗóµÄ¹ĢĢåĪŖŃõ»ÆĢś£¬ÖŹĮæĪŖ24g£¬Ńõ»ÆĢśĪļÖŹµÄĮæĪŖ$\frac{24g}{160g/mol}$=0.15mol£¬ŌņĢśµÄĪļÖŹµÄĮæĪŖ0.3mol£®±ū·ŪÄ©Ķ¶ČĖ×ćĮæµÄÅØŃĪĖįÖŠ·¢Éś·“Ó¦£¬µĆµ½4.8gµ»ĘÉ«³ĮµķŗĶĘųĢåŅŅ£¬Ōņµ»ĘÉ«³ĮµķĪŖS£¬ĪļÖŹµÄĮæĪŖ$\frac{4.8g}{32g/mol}$=0.15mol£¬ŅŅŌŚ±ź×¼×“æöĻĀµÄĆܶČĪŖ1.52g•L-1£¬ŌņŅŅµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ1.52”Į22.4=34£¬ĘųĢåŅŅæÉČÜÓŚĖ®£¬ŌņŅŅĪŖH2S£¬ŌŚ±ūÖŠĢśŌŖĖŲÓėĮņµ„ÖŹµÄĪļÖŹµÄĮæÖ®±ČĪŖ2£ŗ1£¬¶ųŃõ»ÆĪļ¼×ÓėĘųĢ¬Ēā»ÆĪļŅŅ°“1£ŗ3·“Ӧɜ³ÉµÄĪļÖŹ±ū£¬øł¾ŻŌŖĖŲŹŲŗćŗĶµē×ӵƏ§ŹŲŗćæÉĶʶĻ¼×ĪŖFe2O3£¬±ūĪŖFe2S3£¬¼×ÓėŅŅ·¢ÉśµÄ·“Ӧɜ³É±ūµÄ·“Ó¦ĪŖFe2O3+3H2S=Fe2S3+3H2O£¬±ūŌŚŃĪĖįÖŠ·¢Éś·“Ó¦ĪŖFe2S3+4HCl=2H2S”ü+2FeCl2+S£¬·ūŗĻĢāÖŠĢõ¼ž£®
½ā“š ½ā£ŗĻņ±ūÓėÅØŃĪĖį·“Ó¦ŗóµÄĀĖŅŗ£Ø¼ŁÉčŅŅČ«²æŅŻ³ö£©ÖŠ¼ÓČĖ×ćĮæµÄNaOHČÜŅŗ£¬ĻČ³öĻÖ°×É«³Įµķ£¬×īÖÕ×Ŗ±äĪŖŗģŗÖÉ«³Įµķ£¬ŌņĀĖŅŗÖŠŗ¬ÓŠŃĒĢśĄė×Ó£¬×ĘÉÕŗóµÄ¹ĢĢåĪŖŃõ»ÆĢś£¬ÖŹĮæĪŖ24g£¬Ńõ»ÆĢśĪļÖŹµÄĮæĪŖ$\frac{24g}{160g/mol}$=0.15mol£¬ŌņĢśµÄĪļÖŹµÄĮæĪŖ0.3mol£®±ū·ŪÄ©Ķ¶ČĖ×ćĮæµÄÅØŃĪĖįÖŠ·¢Éś·“Ó¦£¬µĆµ½4.8gµ»ĘÉ«³ĮµķŗĶĘųĢåŅŅ£¬Ōņµ»ĘÉ«³ĮµķĪŖS£¬ĪļÖŹµÄĮæĪŖ$\frac{4.8g}{32g/mol}$=0.15mol£¬ŅŅŌŚ±ź×¼×“æöĻĀµÄĆܶČĪŖ1.52g•L-1£¬ŌņŅŅµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ1.52”Į22.4=34£¬ĘųĢåŅŅæÉČÜÓŚĖ®£¬ŌņŅŅĪŖH2S£¬ŌŚ±ūÖŠĢśŌŖĖŲÓėĮņµ„ÖŹµÄĪļÖŹµÄĮæÖ®±ČĪŖ2£ŗ1£¬¶ųŃõ»ÆĪļ¼×ÓėĘųĢ¬Ēā»ÆĪļŅŅ°“1£ŗ3·“Ӧɜ³ÉµÄĪļÖŹ±ū£¬øł¾ŻŌŖĖŲŹŲŗćŗĶµē×ӵƏ§ŹŲŗćæÉĶʶĻ¼×ĪŖFe2O3£¬±ūĪŖFe2S3£¬¼×ÓėŅŅ·¢ÉśµÄ·“Ӧɜ³É±ūµÄ·“Ó¦ĪŖFe2O3+3H2S=Fe2S3+3H2O£¬±ūŌŚŃĪĖįÖŠ·¢Éś·“Ó¦ĪŖFe2S3+4HCl=2H2S”ü+2FeCl2+S£®
£Ø1£©ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬ŹÆÓĶĢś“¢¹Ž¾ĆÖĆ£¬²æ·ÖFe±»Ńõ»Æ±äĪŖFe2O3£¬ĖłŅŌ¼×ŹĒFe2O3£¬
¹Ź“š°øĪŖ£ŗFe2O3£»
£Ø2£©±ūŌŚŃĪĖįÖŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗFe2S3+4H+=2H2S”ü+2Fe2++S£¬
¹Ź“š°øĪŖ£ŗFe2S3+4H+=2H2S”ü+2Fe2++S£»
£Ø3£©±ūÓėŃĪĖį·“Ó¦ŗóµÄĀĖŅŗ±©Ā¶ŌŚæÕĘųÖŠŅ»¶ĪŹ±¼äŃÕÉ«¼ÓÉī£¬ĘäŌŅņŹĒ£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©£ŗ4Fe2++4H++O2=4Fe3++2H2O£¬
¹Ź“š°øĪŖ£ŗ4Fe2++4H++O2=4Fe3++2H2O£»
£Ø4£©A£®ŹÆÓĶČė¹ŽĒ°ĶŃĮņ“¦Ąķ£¬·ĄÖ¹Įņ»ÆĒāµÄÉś³É£¬¹ŹAÕżČ·£»
B£®¶ØĘŚÓĆĖįĒåĻ“¹ŽĢ壬»įŹ¹¹Ž±Ś±ä±”£¬²»ĄūÓŚ“¢“ęÓĶ£¬¹ŹB“ķĪó£»
C£®¹ŽĢåÄŚ±ŚĶæĖ¢ÓĶĘį£¬ÓĶĘįŹĒÓŠ»śĪļ£¬ČŻŅ×ČÜÓŚÓĶÖŠ£¬Ź¹ÓĶ“æ¶Č½µµĶ£¬¹ŹC“ķĪó£»
D£®¹ŽĢåÖŠ³äČėµŖĘų£¬¾ĶæÉŅŌ·ĄÖ¹¹Ž±»Ńõ»Æ²śÉśFe2O3£¬¹ŹDÕżČ·£®
¹ŹŃ”£ŗAD£®
µćĘĄ ±¾Ģāæ¼²éĪŽ»śĪļĶʶĻ£¬Éę¼°Īļ֏֊ѧ»ł±¾²»½Ó“„£¬²ąÖŲæ¼²éѧɜ·ÖĪöĶĘĄķÄÜĮ¦”¢ÖŖŹ¶ĒØŅĘÓ¦ÓĆÄÜĮ¦£¬ÄŃ¶Č½Ļ“ó£®


 æģ½ŻÓ¢ÓļÖÜÖÜĮ·ĻµĮŠ“š°ø
æģ½ŻÓ¢ÓļÖÜÖÜĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ņõ¼«£ŗ2H++2e-ØTH2”ü Ńō¼«£ŗ4OH--4e-ØTO2”ü+2H2O | |
| B£® | Ņõ¼«£ŗCu2++2e-ØTCu Ńō¼«£ŗ4OH--4e-ØTO2”ü+2H2O | |
| C£® | Ņõ¼«£ŗ2H++2e-ØTH2”ü Ńō¼«£ŗ2C1--2e-ØTCl2”ü | |
| D£® | Ņõ¼«£ŗCu2++2e-ØTCu Ńō¼«£ŗ2C1--2e-ØTCl2”ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
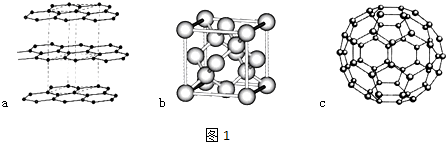
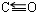 £»Š“³öĮķŅ»ÓėCO»„ĪŖµČµē×ÓĢåµÄ»ÆѧŹ½CN-£®
£»Š“³öĮķŅ»ÓėCO»„ĪŖµČµē×ÓĢåµÄ»ÆѧŹ½CN-£®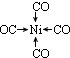 £»Š“³ö»łĢ¬NiŌ×ӵĵē×ÓÅŲ¼Ź½1s22s22p63s23p63d84s2£®
£»Š“³ö»łĢ¬NiŌ×ӵĵē×ÓÅŲ¼Ź½1s22s22p63s23p63d84s2£®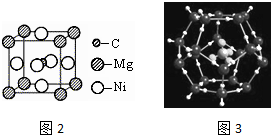
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
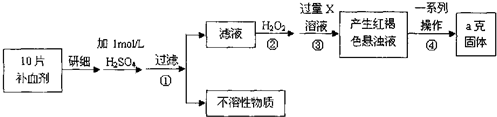
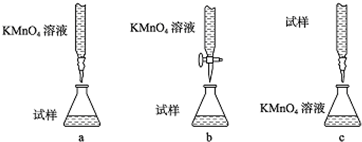
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
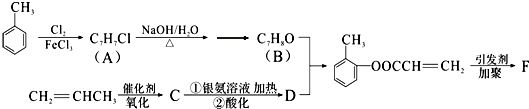
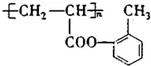
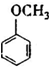 £ØĢī½į¹¹¼ņŹ½£©£®
£ØĢī½į¹¹¼ņŹ½£©£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £ØŅŃÖŖŅŅ“¼µÄ¼üĻߏ½ĪŖ
£ØŅŃÖŖŅŅ“¼µÄ¼üĻߏ½ĪŖ £©
£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŠņŗÅ | µĪ¶ØĒ°¶ĮŹż£ØmL£© | µĪ¶Øŗó¶ĮŹż£ØmL£© |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 22.10 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 20ml 0.1mol/L CH3COONaČÜŅŗÓė10ml 0.1mol/LHClČÜŅŗ»ģŗĻŗóČÜŅŗ³ŹĖįŠŌ£¬ĖłµĆČÜŅŗÖŠ£ŗ c£ØCH3COOH£©£¾c£ØCl-£©£¾c£ØCH3COO-£©£¾c£ØH+£© | |
| B£® | µČĪļÖŹµÄĮæÅØ¶ČµČĢå»żµÄNH4HSO4ŗĶNaOHČÜŅŗ»ģŗĻ£ŗc£ØNa+£©=c£ØSO42-£©£¾c£ØNH4+£©£¾c£ØH+£©£¾c£ØOH-£© | |
| C£® | ŹŅĪĀĻĀ£¬pH=2µÄŃĪĖįÓėpH=12µÄ°±Ė®µČĢå»ż»ģŗĻ£¬ĖłµĆČÜŅŗÖŠ£ŗc£ØCl-£©+c£ØH+£©£¾c£ØNH4+ £©+c£ØOH-£© | |
| D£® | ²ŻĖįÄĘ£ØNa2C2O4£©ČÜŅŗÖŠ£ŗc£ØOH-£©=c£ØH+£©+c£ØHC2O4£©+c£ØH2C2O4£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com