
【题目】某化学学习小组设计如图实验装置(夹持和加热装置略去)制备Cl2,并探究氯气的相关性质。

回答下列问题:
⑴ 装置中a玻璃仪器的名称为_____________;整套装置装配完毕后,首先进行的操作是______________,再添加试剂。
⑵ 若A装置中的固体药品为MnO2,其化学方程式为_______________________。若A装置中的固体药品为KClO3,则反应中每生成1 mol Cl2时转移电子的物质的量为_________mol(结果保留两位小数)。
⑶ 装置C的作用是验证氯气是否具有漂白性,Ⅰ处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是_________、_____________。
⑷ 设计装置D、E的目的是比较氯、溴、碘的非金属性。但有同学认为该设计不够严密,他的理由可能是_____________。
⑸ 甲同学提出,装置F中改用过量的Na2SO3溶液,乙同学认为此法不可行。请用离子方程式解释乙认为不可行的原因:_____________。
【答案】分液漏斗 检查气密性 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 1.67 无水氯化钙 干燥的有色布条 不能排除氯气对溴、碘的非金属性强弱实验的干扰 SO32-+Cl2+H2O=SO42-+2Cl-+2H+、 SO32-+2H+===SO2↑+H2O
MnCl2+Cl2↑+2H2O 1.67 无水氯化钙 干燥的有色布条 不能排除氯气对溴、碘的非金属性强弱实验的干扰 SO32-+Cl2+H2O=SO42-+2Cl-+2H+、 SO32-+2H+===SO2↑+H2O
【解析】
(1)仪器a为分液漏斗,该实验目的是制备Cl2,因此装配完毕后,应检验装置的气密性;
(2)MnO2与浓盐酸反应制备Cl2,反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;如果药品是KClO3,发生反应方程式为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,每生成1molCl2,转移电子物质的量为1mol×5/3≈1.67mol;
MnCl2+Cl2↑+2H2O;如果药品是KClO3,发生反应方程式为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,每生成1molCl2,转移电子物质的量为1mol×5/3≈1.67mol;
(3)验证Cl2是否具有漂白性,I处为湿润的有色布条,II处作用为干燥氯气,根据仪器特点,盛放的药品为无水氯化钙或者为P2O5,Ⅲ处应与I处作对照实验,因此Ⅲ处应为干燥有色布条;
(4)比较氯、溴、碘的非金属性,利用置换反应,根据装置图,Cl2可能与KI溶液反应,对比较溴和碘非金属性产生干扰,因此缺陷是不能排除氯气对溴、碘的非金属性强弱实验的干扰;
(5)Cl2具有强氧化性,能把Na2SO3氧化成Na2SO4,离子反应方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+,所加Na2SO3为过量,因此2H++SO32-=SO2↑+H2O,SO2有毒,对环境有污染。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】水是地球上最常见的物质之一,是所有生命生存的重要资源。
(1)![]() 键和
键和![]() 键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为________;水溶液中存在H3O+离子,写出该微粒的结构式________(标出配位键)。
键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为________;水溶液中存在H3O+离子,写出该微粒的结构式________(标出配位键)。
(2)科学家发现在特殊条件下,水能表现出许多种有趣的结构和性质
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下:
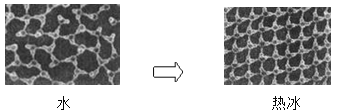
使水结成“热冰”采用“弱电场”的条件,说明水分子是______分子。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用力类型完全相同的是______。
A.固态氨 B.食盐 C.干冰 D.金刚石
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。产生的阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式__________;该阳离子还能与水作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式____________________。
(3)水的性质中的一些特殊现象对于生命的存在意义非凡,请解释水的分解温度远高于其沸点的原因______________________;试从结构的角度分析固态水(冰)的密度小于液态水的密度的原因是___________________________。
(4)甲烷的气体水合物晶体称为可燃冰,存在于海底和冰川底部,是巨大的潜在能源。在可燃冰晶体中,甲烷分子装在水分子构成的笼内,假设可燃冰晶体中的水笼里装的都是甲烷,理想的可燃冰晶胞组成为8CH4·46H2O,X-射线衍射分析表明,可燃冰晶体属于立方晶体,晶胞参数a=1200pm。则该晶体的密度为________g/cm3(计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol; CO(g)+
O2(g)=CO(g) ΔH=-110.5 kJ/mol; CO(g)+![]() O2(g)=CO2(g) ΔH=-283 kJ/mol,在36 g碳不完全燃烧所得气体中,CO占
O2(g)=CO2(g) ΔH=-283 kJ/mol,在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积,且与这些碳完全燃烧相比,损失的热量是
体积,且与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJB. 283 kJC. 566 kJD. 1149 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表提供的数据,判断下列离子方程式或化学方程式正确的是
化学式 | 电离常数 |
HClO | K = 3×10-8 |
H2CO3 | K1 = 4×10-7 K2 = 6×10-11 |
A. 向NaClO溶液中通少量CO2:CO2+NaClO+H2O===NaHCO3+HClO
B. 向NaClO溶液中通过量CO2:CO2+2NaClO+H2O===Na2CO3+2HClO
C. 向Na2CO3溶液中滴加少量氯水:CO32-+2Cl2+H2O===2Cl-+2HClO+CO2↑
D. 向NaHCO3溶液中滴加少量氯水:2HCO3-+Cl2===Cl-+ClO-+2CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用它。
(1)工业上通常采用电解法制氯气,请观察图后回答下列问题:
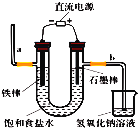
①请写出该反应的化学方程式____。
②通电后,b侧产生的气体是____![]() 填化学式
填化学式![]() 。
。
(2)某学生设计如图所示的实验装置,利用浓盐酸和二氧化锰固体制取氯气,并与潮湿的消石灰反应制取少量漂白粉![]() 这是一个放热反应
这是一个放热反应![]() ,回答下列问题:
,回答下列问题:
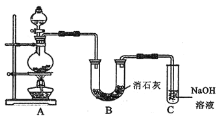
①漂白粉将在B装置的U形管中产生,其化学方程式是_____。
②装置C的作用是___。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3) 2,为避免此副反应的发生,可采取的措施是___。
②为避免另一个副反应的发生,可将装置作何改进___ 。
③家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是____。
A.食盐 B.食醋 C.烧碱 D.纯碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是( )
CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是( )
A. △H2>△H3B. △H1+△H3 =△H2
C. △H1<△H3D. △H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3可采用电解法制备,装置如图所示。下列叙述正确的是

A. 通电后阴极的电极反应式2H2O+2e-=2OH-+H2↑
B. 电解过程中通过阳离子交换膜的离子主要为K+,其迁移方向是从右到左
C. 电解过程中阳极附近pH增大
D. 当电路中通过1mol电子的电量时,会有0.5mol的KIO3生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蓓萨罗丁是一种治疗顽固性皮肤T细胞淋巴瘤的药物,其结构如图所示。下列有关说法正确的是

A. 分子中所有碳原子在同一平面内
B. 既能发生加成反应,又能发生消去反应
C. 能使溴水、酸性高锰酸钾溶液褪色,且原理相同
D. 1mol蓓萨罗丁分别与足量的Na、 NaHCO3反应,产生气体的物质的量之比为l︰2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com