
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:①![]() H=180.5kJ·
H=180.5kJ·![]()
②C和CO的燃烧热(H)分别为-393.5kJ·![]() 和-283kJ·
和-283kJ·![]()
则2NO(g)+2CO(g)=N2(g)+2CO2(g) H=_________kJ·![]()
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
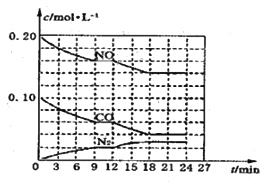
①CO在0—9min内的平均反应速率![]() =__________ mol·L-1·
=__________ mol·L-1·![]() (保留两位有效数字);第12min时改变的反应条件可能为_________。
(保留两位有效数字);第12min时改变的反应条件可能为_________。
A.升高温度 B.加入NO
C.加催化剂 D.降低温度
②该反应在第18min时又达到平衡状态,此时![]() 的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的![]() 转化为HCOOH和
转化为HCOOH和![]() 。已知常温下0.1mol·
。已知常温下0.1mol·![]() 的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
【答案】 -746.5 4.4×10-3 D 22.2% 3.4 1.0×10-7
【解析】试题分析:本题考查盖斯定律的应用,图像的分析,化学反应速率和化学平衡的计算,外界条件对化学反应速率和化学平衡的影响,电离平衡常数的计算。
(1)①N2(g)+O2(g)=2NO(g) ΔH=180.5kJ/mol
根据C和CO的燃烧热可写出热化学方程式
②C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
③CO(g)+![]() O2(g)=CO2(g) ΔH=-283kJ/mol
O2(g)=CO2(g) ΔH=-283kJ/mol
应用盖斯定律,③![]() 2-①得,2NO(g)+2CO(g)=N2(g)+2CO2(g)ΔH=2
2-①得,2NO(g)+2CO(g)=N2(g)+2CO2(g)ΔH=2![]() (-283kJ/mol)-(180.5kJ/mol)=-746.5kJ/mol。
(-283kJ/mol)-(180.5kJ/mol)=-746.5kJ/mol。
(2)①由图像可知0~9min内的平均反应速率υ(CO)=![]() =
=![]() =4.4
=4.4![]() 10-3mol/(L·min)。根据图像9min时反应达到平衡状态,9~12min保持平衡状态,12min时改变条件,18min达到新平衡,此过程中υ(CO)=
10-3mol/(L·min)。根据图像9min时反应达到平衡状态,9~12min保持平衡状态,12min时改变条件,18min达到新平衡,此过程中υ(CO)=![]() =
=![]() =3.3
=3.3![]() 10-3mol/(L·min),12min~18min内NO、CO浓度减小,N2浓度增大,12min时改变条件化学反应速率减慢,平衡向正反应方向移动。A,升高温度,化学反应速率加快,平衡向逆反应方向移动,A项不可能;B,加入NO,NO的浓度应突然增大,化学反应速率加快,平衡向正反应方向移动,B项不可能;C,加入催化剂,化学反应速率加快,平衡不移动,C项不可能;D,降低温度,化学反应速率减慢,平衡向正反应方向移动,D项可能;答案选D。
10-3mol/(L·min),12min~18min内NO、CO浓度减小,N2浓度增大,12min时改变条件化学反应速率减慢,平衡向正反应方向移动。A,升高温度,化学反应速率加快,平衡向逆反应方向移动,A项不可能;B,加入NO,NO的浓度应突然增大,化学反应速率加快,平衡向正反应方向移动,B项不可能;C,加入催化剂,化学反应速率加快,平衡不移动,C项不可能;D,降低温度,化学反应速率减慢,平衡向正反应方向移动,D项可能;答案选D。
②根据图像写出到18min时的三段式
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
c(起始)(mol/L) 0.2 0.1 0 0
c(转化)(mol/L)0.06 0.06 0.03 0.06
c(平衡)(mol/L)0.14 0.04 0.03 0.06
此时CO2的体积分数为![]() 100%=22.2%。化学平衡常数K=
100%=22.2%。化学平衡常数K=![]() =
=![]() =3.4。
=3.4。
(3)0.1mol/LHCOONa溶液的pH=10,溶液中c(H+)=1![]() 10-10mol/L,溶液中c(OH-)=1
10-10mol/L,溶液中c(OH-)=1![]() 10-4mol/L,根据水解平衡方程式HCOO-+H2O
10-4mol/L,根据水解平衡方程式HCOO-+H2O![]() HCOOH+OH-,溶液中c(HCOOH)=1
HCOOH+OH-,溶液中c(HCOOH)=1![]() 10-4mol/L,c(HCOO-)=0.1mol/L-1
10-4mol/L,c(HCOO-)=0.1mol/L-1![]() 10-4mol/L
10-4mol/L![]() 0.1mol/L,HCOOH的电离常数Ka=
0.1mol/L,HCOOH的电离常数Ka=![]() =
=![]() =1
=1![]() 10-7。
10-7。


科目:高中化学 来源: 题型:
【题目】化学与社会、生产和生活密切相关。下列说法错误的是
A.科学家在室温下将气态二氧化碳转化为固体碳材料,该变化是化学变化
B.中国天眼用到碳化硅,芯片用到高纯硅,石英玻璃用到硅酸盐
C.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机金属材料
D.看电影时,我们可以看到放映机投射的光柱,这是气溶胶发生的丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是
A.苯在常温常压下为易燃气体B.乙烯可发生加聚反应
C.乙醇和乙酸分子中都含有C=O键D.分子式为C4H10的物质一定是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在一定条件下能大量共存,且加入相应试剂后所对应的离子方程式正确的是
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A |
| 稀硫酸 |
|
B |
| 氢氧化钠溶液 |
|
C |
| 氢氧化钠溶液 |
|
D |
| 过量氢氧化钠溶液 |
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或用途与浓硫酸的脱水性有关的是( )
A.浓硫酸可作氯气的干燥剂
B.浓硫酸滴加到胆矾上,蓝色晶体变成白色粉末
C.浓硫酸滴加到蔗糖中,蔗糖变黑
D.浓硫酸在加热条件下可与铜等不活泼金属反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min 后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(Lmin)。
xC(g)+2D(g),5min 后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(Lmin)。
(1)B的反应速率v(B)=_____________,X=_____。
(2)A在5min末的浓度是________________。
(3)此时容器内的压强与开始时之比为_________。
Ⅱ.(4)二氯化二硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a.S2Cl2分子中所有原子都满足8电子稳定结构,写出它的电子式____________;
b.指出它分子内的键型_________。
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在过去,糖尿病的检测方法是把NaOH溶液和CuSO4溶液加入某病人的尿液中,微热时,如果观察到红色沉淀,说明该尿液中含有 ( )
A. 食醋 B. 白酒 C. 食盐 D. 葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国在航空航天事业上取得了令人瞩目的成就,科学家在能量的转化,航天器的零排放作出了很大的努力,其中为了达到零排放的要求,循环利用人体呼出的CO2并提供O2,设计了一种装置(如图)实现了能量的转化,总反应方程式为2CO2=2CO+O2。关于该装置下列说法正确的是( )

A. 装置中离子交换膜为阳离子交换膜
B. 反应完毕,电解质溶液碱性减弱
C. N型半导体为阳极,P型半导体为阴极
D. CO2参与X电极的反应方程式:CO2+2e-+H2O=CO+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是

A. 在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力大于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)与α(HA-)不一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com