
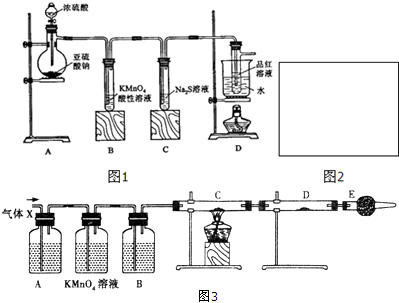
分析 (1)根据化学常用仪器及仪器的名称来分析;制备二氧化硫的方法是利用亚硫酸钠和浓硫酸反应生成;
(2)利用二氧化硫与高锰酸钾溶液,二氧化硫与硫化钠的氧化还原反应来分析反应现象和性质,依据离子性质和电荷守恒,原子守恒配平书写离子方程式;
(3)根据二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色来解答;
(4)二氧化硫有毒,没有使用尾气吸收装置;可以使用氢氧化钠溶液吸收多余的二氧化硫;
(5)二氧化硫是否存在可用品红溶液检验;浓硫酸具有吸水性;碱石灰可吸收水和二氧化碳;
(6)氢气和氧化铜反应生成铜和水,水和无水硫酸铜反应生成蓝色的五水合硫酸铜.
解答 解:(1)装置A中盛放亚硫酸钠的仪器名称是蒸馏烧瓶,利用亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
故答案为:蒸馏烧瓶;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)高锰酸钾溶液为紫红色,具有氧化性,二氧化硫具有还原性,二者发生氧化还原反应,则观察到红色逐渐变浅直至完全褪去,二氧化硫进入硫化钠溶液中发生的氧化还原反应为2S2-+SO2+2H2O=3S↓+4OH-,则观察到出现黄色浑浊,B中S元素的化合价升高,表现还原性,C中二氧化硫中硫元素的化合价降低,表现氧化性,高锰酸钾溶液和二氧化硫气体发生的离子反应为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;
故答案为:溶液由紫红色变为无色;无色溶液中出现淡黄色浑浊;还原性;氧化性;2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;
(3)因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,则操作为待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,观察到的现象为无色溶液恢复为红色,
故答案为:品红溶液褪色后,关闭分液漏斗活塞,点燃D处酒精灯加热,溶液恢复红色;
(4)二氧化硫是一种有毒气体,多余的二氧化硫不能直接排放到空气中,图示中缺少尾气吸收装置;二氧化硫能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收多余的二氧化硫,装置如图: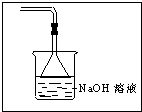 ,
,
故答案为:缺少尾气吸收装置; ;
;
(5)A装置的作用是检验二氧化硫的存在,二氧化硫能漂白品红,所以通过品红溶液褪色检验SO2的存在,现象是品红褪色;为了检验氢气的存在,需用无水硫酸铜检验氢气被氧化的产物水,所以事先需除掉水,利用浓硫酸吸收水蒸气;碱石灰的主要成分为氧化钙和氢氧化钠,能吸收水和二氧化碳,为防止空气中的水蒸气进入D中,E中加入的试剂可能是碱石灰,
故答案为:品红溶液;检验SO2;浓硫酸;吸收水蒸气; 碱石灰;防止空气中的水蒸气进入D中;
(6)为了检验氢气的存在,氢气与氧化铜在加热条件下反应生成铜和水,该反应的化学方程式为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O黑色CuO变成红色的Cu,需用无水硫酸铜检验氢气被氧化的产物水,水和无水硫酸铜反应生成蓝色的五水合硫酸铜,所以可以证明气体X中含有H2的实验现象是C中黑色CuO变成红色的Cu;D中白色粉末变成蓝色,
故答案为:黑色CuO变成红色的Cu;白色粉末变成蓝色.
点评 本题考查了浓硫酸的性质,题目难度中等,试题涉及铜与浓硫酸、锌与浓硫酸的反应,题量较大、知识点较多,充分考查了学生的分析、理解能力及化学实验能力,明确常见气体的性质及检验方法为解答关键.


科目:高中化学 来源: 题型:选择题
| A. | 熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:溴苯>H2O>苯 | |
| C. | 含碳量:甲烷>乙烯>乙炔>苯 | |
| D. | 等物质的量燃烧耗O2量:己烷<环己烷<苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
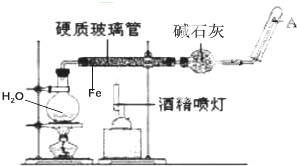 如图是在高温下,Fe与水蒸气的反应实验.
如图是在高温下,Fe与水蒸气的反应实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
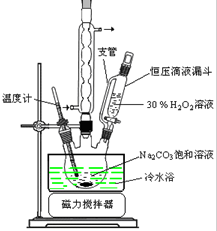 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 投料比 CO体积分数/% 温度/℃ | $\frac{n{H}_{2}O}{n(CO)}$=1 | $\frac{n{H}_{2}O}{n(CO)}$=3 | $\frac{n{H}_{2}O}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 | B. | 2.3 | C. | 3.0 | D. | 7.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com