
 如图所示,溶液体积均为200mL,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,溶液体积均为200mL,若电解5min时铜电极质量增加2.16g,试回答:
| ||
| ||
| 2.16g |
| 108g/mol |
| 0.02mol |
| 0.2L |
| 2.16g |
| 108g/mol |
| 1 |
| 4 |
| 0.005mol |
| 0.2L |
| ||
| ||


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
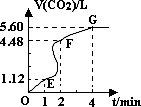
(8分)向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)。请回答下列问题:
(1)设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速率为v3,则v1、v2、v3从大到小的顺序为
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 ( )
 A、蒸馏水 B、氯化钾固体 C、氯化钠溶液 D、浓盐酸
A、蒸馏水 B、氯化钾固体 C、氯化钠溶液 D、浓盐酸
(3)加入CaCO3的质量为 。
若反应过程中溶液体积的变化忽略不计,
则EF段用盐酸表示的化学反应速率 V(HCL)==____________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省洪湖市第二中学五校高一期中联考化学试卷(带解析) 题型:填空题
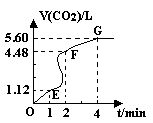
(5分)向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)。
请回答下列问题:
(1)设OE段的反应速率为 1,EF段的反应速率为
1,EF段的反应速率为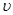 2,FG段的反应速率为
2,FG段的反应速率为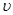 3,则
3,则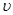 1、
1、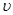 2、
2、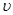 3从大到小的顺序为 。
3从大到小的顺序为 。
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 (填字母)。
| A.蒸馏水 | B.氯化钾固体 |
| C.氯化钠溶液 | D.浓盐酸 |
 (HCl)= 。
(HCl)= 。查看答案和解析>>
科目:高中化学 来源:2011-2012年广东雷州、徐闻中学高一下学期第二次联考化学试卷(带解析) 题型:填空题
( 8分 )向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)。请回答下列问题: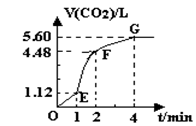
(1)设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速率为v3,则v1、v2、v3从大到小的顺序为
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 (填字母)。
| A.蒸馏水 | B.氯化钾固体 | C.氯化钠溶液 | D.浓盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com