
【题目】下列叙述不正确的是( )
A. 质量相等的O2和O3中所含原子数相等
B. 物质的量相等的O2和O3中含分子数相等
C. 质量相等的CO和CO2中所含碳原子数相等
D. 物质的量相等的CO和CO2中含碳原子数相等
【答案】C
【解析】
A、根据n=m/M、N=nNA可知,质量相等的质量相等的O2和O3,O2和O3都是由氧原子构成的,氧原子的质量相等,故含有氧原子相等;
B、根据N=nNA可知,分子数目之比等于物质的量之比;
C、根据n=m/M求其分子个数比,再利用这两种物质的分子构成解题;
D.物质的量相同,含有分子数目相同,二者含有的碳原子数目之比等于分子中含有的碳原子数目之比.
A、根据n=m/M、N=nNA可知,质量相等的质量相等的O2和O3,O2和O3都是由氧原子构成的,氧原子的质量相等,故含有氧原子相等;或这样解答:质量相等的质量相等的O2和O3,分子个数之比与摩尔质量成反比,所以等质量的O2和O3的含有的分子数目之比为48g·mol-1:32g·mol-1=3:2;故等质量O2和O3的含有的原子数目之比为(3×2):(2×3)=1:1,故A正确;
B、根据N=nNA可知,等物质的量的O2和O3所含分子个数比为1:1,故B正确;
C、假设两物质的质量都是m,则两物质的分子个数比是:![]() =11:7,则碳原子的个数比是:11:7,故C错误;
=11:7,则碳原子的个数比是:11:7,故C错误;
D、物质的量相同,二者含有分子数目相同,CO和CO2分子中C原子数目分别为1、1,故二者所含的C原子数目之比为1:1,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。
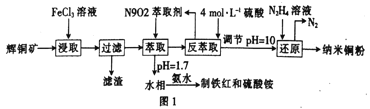
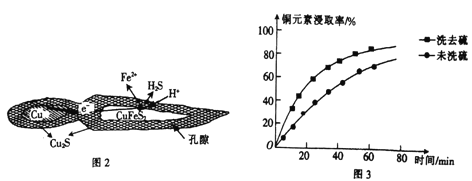
(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为____________________________。
(2)从辉铜矿中浸取铜元素时,可用FeCl 3溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl下标2+S,每生成1molCuCl2,反应中转移电子的物质的量为_____;浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为_________。
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3所示,未洗硫时铜元素浸取率较低,其原因是________________。
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是_________________。

(4)用“反萃取”得到的CuSO4 溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为_____。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____、干燥、____等操作可得到Fe2O3 产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象或事实解释正确的是( )。
选项 | 实验现象或事实 | 解释 |
A | 检验待测液中S | 先滴入盐酸可排除Ag+、C |
B | 制备乙酸乙酯时,导管应伸入试管至饱和Na2CO3溶液的液面上方 | 乙酸乙酯易溶于碳酸钠溶液,防止发生倒吸 |
C | 向Fe(NO3)2溶液中加入稀硫酸,试管口有红棕色气体产生 | 溶液中N |
D | 含Mg(HCO3)2的硬水长时间充分加热,最终得到的沉淀物的主要成分为Mg(OH)2,而不是MgCO3 | Ksp(MgCO3)<Ksp[Mg(OH)2] |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】页岩气是从页岩层中开采的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) = CO(g)+3H2(g) ΔH1。已知:CH4、H2、CO的燃烧热(ΔH)分别为-a kJ·mol-1、-b kJ·mol-1、-c kJ·mol-1;H2O(l)=H2O(g) ΔH=+d kJ·mol-1。
则ΔH1=______________(用含字母a、b、c、d的代数式表示)kJ·mol-1。
(2)用合成气生成甲醇的反应为CO(g)+2H2(g)![]() CH3OH(g) ΔH2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:
CH3OH(g) ΔH2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:

200 ℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH2____(填“>”“<”或“=”)0。
②写出两条可同时提高反应速率和CO转化率的措施:_____。
③下列说法正确的是____(填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强:p1<p2
④0~3 min内用CH3OH表示的反应速率v(CH3OH)=____mol·L-1·min-1。
⑤200 ℃时,该反应的平衡常数K=____。向上述200 ℃达到平衡的恒容密闭容器中再加入2 mol CO、4 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____(填“正向”“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下充入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.所有物质中一定存在化学键
B.含共价键的化合物不一定是共价化合物
C.金属元素和非金属元素形成的化合物一定是离子化合物
D.溶于水能导电的化合物就是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列说法错误的是
A.铝合金大量用于高铁建设B.活性炭具有除异味和杀菌作用
C.生石灰可用作袋装食品干燥剂D.光束通过云、雾会产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据最新报道,贵州发现超大型锰矿,整个矿区资源量超两亿吨。锰矿是继铁矿、铝矿之后,排在第三位的金属矿产,属国家战略紧铁矿产之一,在电池、磁性新材料等方面都有广泛应用。中国是全球最大的锰矿石和锰系材料生产、清费大国,回答下列问题:
(1)基态锰原子的价层电子排布式为_________。
(2)铜锰氧化物(CuMn2O4) 能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
①CO 和N2 互为等电于体。CO 分子中σ键和π键数目之比为________。
②HCHO分子的H-C-H 键角______(填“大于”“小于”或“等于”)CO2的键角,理由是__________。
③ 向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶被中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。CO32-的空间构型是____________。
(3)晶体熔点: Fe2O3晶体______Al2O3晶体(填“>”“<”或“=”),理由是___________。
(4)锰、铁的第三电离能(I3) 较大的是_______(填素符号)。
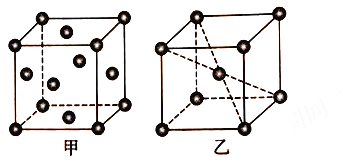
(5) 铝晶胞如图26甲所示。铝晶胞中,铝原子的配位数为________。已知铝的晶体密度为ρ g·cm-3,N A代表阿伏加德罗常数的值,设铝原子的半径为rpm,则r=_______。
(6)锰晶胞如图乙所示。已知锰晶胞参数为a nm。设锰晶胞中两个锰原子核之间最短距离为dnm,则d=_____。锰晶胞中Mn 的空间利用率φ=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某气态烃X在标准状态下的密度为1.16 g/L,A能发生银镜反应,E具有特殊香味,有关物质的转化关系如下:

请回答:
(1)B中含有的官能团名称是_____________,反应④的反应类型为_____________。
(2)写出反应①的化学方程式_____________。
(3)下列说法正确的是_____________。
A.有机物D在加热条件下可以使黑色的氧化铜变红
B.有机物A分子中的所有原子在同一平面上
C.有机物B与C在一定条件下可以反应生成有机物E
D.有机物E中混有B和D,可用NaOH溶液将E分离出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com