
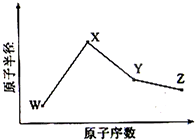
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.下列表述中不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.下列表述中不正确的是( )| A、X位于元素周期表中第三周期第IA 族 |
| B、W的基态原子核外有2个未成对电子 |
| C、X的单质和Y的单质相比,熔点较高的是X |
| D、Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是SiCl4+3H2O=H2SiO3↓+4HCl |


科目:高中化学 来源: 题型:
| A、Na2S+2CH3COOH(足量)=2CH3COONa+H2S↑ |
| B、Na2S+2CH3COOH(少量)=2CH3COONa+H2S↑ |
| C、Na2S(少量)+CH3COOH=CH3COONa+NaHS |
| D、CH3COOH+NaHS=CH3COONa+H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 实验方法 | 实验现象 |
| 验证氧化性 | ||
| 验证不稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W |
| A、常压下,W的常见单质有金刚石和石墨 |
| B、Z的阳离子与Y的阴离子电子层结构相同 |
| C、X的气态氢化物比Y的气态氢化物稳定 |
| D、W元素的金属性比Z元素的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先加入酸性高锰酸钾溶液,后加银氨溶液,微热 |
| B、先加入溴水,后加酸性高锰酸钾溶液 |
| C、先加入新制氢氧化铜悬浊液,加热,调PH至酸性再加入溴水 |
| D、先加入银氨溶液,再另取该物质加入溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KClO3和SO3溶于水能导电,故KClO3和SO3为电解质 |
| B、在蒸馏水中滴加浓H2SO4,Kw增大 |
| C、常温下将pH=4的醋酸溶液稀释后,溶液中导电离子的数目减少 |
| D、NaCl溶液和CH3COONH4溶液均呈中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用NaOH溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 |
| B、用丁达尔效应鉴别碳酸溶液和硅酸溶胶 |
| C、用焰色反应鉴别KCl和KNO3 |
| D、用澄清石灰水鉴别SO2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验编号 | 1 | 2 | 3 |
| 混合物的质量g | 3.38 | 5.07 | 6.76 |
| 硫酸溶液的体积ml | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量mol | 0.03 | 0.035 | 0.03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com