
对某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色无味的气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO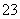
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO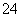
C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH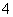
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
科目:高中化学 来源: 题型:
)有一瓶无色溶液,其中可能含有NH4+、K+ 、Mg2+、Ba2+、Al3+ 、Fe3+、I-、Cl-、NO3-、CO32-、SO42-取该溶液进行以下实验:
①该溶液可使pH试纸呈红色;
②取少量溶液加新制氯水及CCl4振荡,可见CCl4层呈现紫色;
③取少量溶液加氯化钡溶液,有白色沉淀生成,加人HNO3后沉淀不溶解;
④取实验③之上层清液,加入硝酸银溶液有白色沉淀生成,加入HNO3后沉淀不溶解;
⑤取少量原溶液加入NaOH溶液呈碱性,在此过程中有白色沉淀生成,而后又逐渐消失,将此溶液加热,有无色气休放出,该气体能使润湿的红色石蕊试纸变蓝。
根据上述实验事实,溶液中肯定存在的离子有_____________________,肯定不存在的离子有_____________________,不能确定是否存在的离子有_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
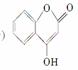 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
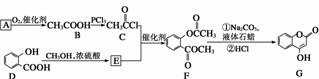
(1)A与银氨溶液反应有银镜生成,则A的结构简式是
________________________________________________________________________。
(2)B→C的反应类型是______________。
(3)E的结构简式是
________________________________________________________________________。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:
________________________________________________________________________
_______________________________________________________________________。
(5)下列关于G的说法正确的是________。
a.能与溴单质反应
b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应
d.分子式是C9H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
为研究金属腐蚀的条件和速率,某课外兴趣活动小组学生用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,再放置于玻璃钟罩里保存相同的一段时间,下列对实验结束时现象的描述不正确的是( )
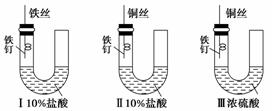
A.实验结束时,装置Ⅰ左侧的液面一定会下降
B.实验结束时,左侧液面装置Ⅰ比装置Ⅱ的低
C.实验结束时,装置Ⅱ中的铁钉腐蚀最严重
D.实验结束时,装置Ⅲ中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下图所示流程进行一系列反应来制备无水AlCl3。
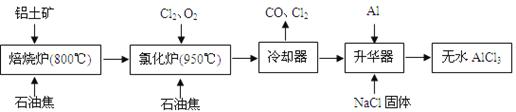
(1)氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则AlCl3是 晶体,其结构式为 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式是 。
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,此反应的离子方程式为: 。
(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是: 。
(5)AlCl3产品中Fe元素含量直接影响其品质,为测定产品中Fe元素的含量,现称取16.25g无水AlCl3产品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重残留固体质量为0.32g。则产品中Fe元素的含量为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜及其化合物在生产生活中有着广泛的应用,铜在化合物中的常见化合价有+1、+2。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
(2)将少量铜丝放人适量的稀硫酸中,温度控制在50℃-60℃,加入H2O,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:__________________________________。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式___________________________。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:
Cu+H2SO4 ________________________________________________。
________________________________________________。
②乙同学认为:黑色固体除CuO外,还可能含有Cu2S和CuS,其理由可能是____(填字母)。
a. Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价升高与S的化合价降低有多种可能
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列实验设计和结论相符的是
A.加入NaOH溶液并加热,能产生使湿润红色石蕊试纸变蓝气体,则一定含有NH4+
B.将SO2通入溴水,溴水褪色,说明SO2具有漂白性
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D.在含FeC12杂质的FeCl3溶液中通入足里C12后,充分加热除去过量的C12,即可得到较纯净的FeC13溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
2009年10月1日,在天安门广场举行了隆重的国庆阅兵仪式,展现了我国强大的综合国力,其中坦克的展示无疑是一个巨大的亮点。坦克的制造材料主要是各种金属的合金,钢铁便是其中十分重要的一种。下列关于铁的说法中,正确的是
A.铁元素属于过渡元素,其原子序数为26 B.单质铁与浓硫酸在常温下不反应
C.铁单质只具有还原性,其阳离子只具有氧化性
D.与相同浓度的盐酸反应生成氢气的速率,纯铁比生铁的快
查看答案和解析>>
科目:高中化学 来源: 题型:
科学研究表明,月球上有丰富的 He资源,可开发利用作未来的新型能源。
He资源,可开发利用作未来的新型能源。
(1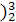 He的中子数是
He的中子数是 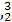 He与
He与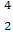 He互称为 。
He互称为 。
(2)α粒子是带有2个单位正电荷、质量数为4的原子核,由此推断α粒子含有
个质子和 个中子。
(3)在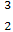 He
He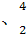 He两种核素中,原子核内的中子数之差为 ,与α粒子有相同质子数和中子数的是 。
He两种核素中,原子核内的中子数之差为 ,与α粒子有相同质子数和中子数的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com