

分析 根据工艺流程图,往制溴母液中加脱色剂脱色后,加入饱和氯化钙溶液是为了除去溶液中的SO42-,沉淀为二水和硫酸钙,过滤后加入的试剂X要除去Fe3+,但不能沉淀Mg2+,也不能引入新杂质离子,故不能用NaOH、KOH,可选用含镁离子的物质碳酸镁或氧化镁,调节溶液pH使Fe3+沉淀而除去,最后对生成的氯化镁蒸发浓缩、冷切结晶、过滤、洗涤、干燥,在氯化氢气流中蒸干得无水氯化镁,据此回答.
解答 解:(1)在蒸发过程中需要用到的仪器有铁架台、酒精灯、玻璃棒和蒸发皿;最后对生成的氯化镁蒸发浓缩、冷切结晶、过滤、洗涤、干燥,在氯化氢气流中蒸干得无水氯化镁,故答案为:玻璃棒;蒸发皿;冷却;洗涤;
(2)加入饱和氯化钙溶液是为了除去溶液中的SO42-,沉淀为二水和硫酸钙,反应离子方程式为Ca2++SO42-+2H2O=CaSO4•2H2O↓,不选用氯化钡是因为钡离子为重金属阳离子,有毒,故答案为:Ca2++SO42-+2H2O=CaSO4•2H2O↓;钡离子有毒;
(3)①过滤后加入的试剂X要除去Fe3+,但不能沉淀Mg2+,也不能引入新杂质离子,故不能用NaOH、KOH,可选用含镁离子的物质碳酸镁或氧化镁,调节溶液pH使Fe3+沉淀而除去,故答案为:BC;
②常温时,Fe(OH)3的Ksp=1×10-39,要使溶液中的Fe3+沉淀完全,残留在溶液中的c(Fe3+)<10-5mol•L-1;
Ksp=c(Fe3+)c3(OH-)=10-5×c3(OH-)=1×10-39
c(OH-)=$\root{3}{\frac{1{0}^{-39}}{1{0}^{-5}}}$mol/L,c(H+)=$\frac{1{0}^{-14}}{c(O{H}^{-})}$,结合pH的计算公式,带入数据可知pH=2.7,故答案为:2.7.
点评 该题以制备食用氯化镁(MgCl2•6HO)为载体,重点考查学生对工艺流程试题了解掌握情况,试题综合性强,贴近高考,侧重对学生能力的培养和训练.


科目:高中化学 来源: 题型:选择题
| A. | 中和滴定、pH试纸 | B. | 蒸馏、Na2CO3溶液 | ||
| C. | 电解、NaOH溶液 | D. | 酯化反应、石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
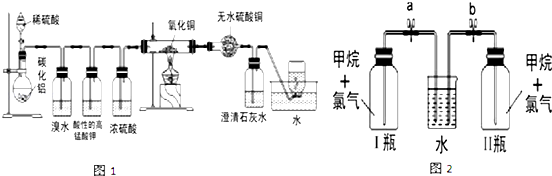
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊不消失 | Na[Al(OH)4]溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
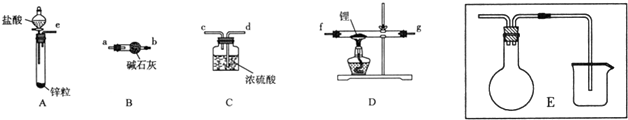
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠、过氧化钠、氢氧化钠、碳酸钠灼烧时火焰呈黄色 | |
| B. | 切开的金属钠暴露在空气中,光亮的表面变暗发生2Na+O2═Na2O2反应 | |
| C. | 过氧化钠在潮湿空气放一段时间变成白色粘稠物的反应主要是:2Na2O2+2H2O═4NaOH+O2↑ | |
| D. | 过氧化钠投入硫酸铜溶液可产生氢氧化铜沉淀和氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com