

分析 菱锰矿中加入稀硫酸,发生的反应为MgCO3+H2SO4=MgSO4+CO2↑+H2O、FeCO3+H2SO4=FeSO4+H2O+CO2↑,然后过滤得到滤渣1和溶液,向溶液中加入双氧水,亚铁离子被氧化生成铁离子,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,向溶液中加入氨水,并调节溶液的pH为4左右,发生的离子反应为Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+,铁离子转化为沉淀,然后过滤得到滤渣2为Fe(OH)3,经过一系列操作最后和木炭煅烧得到MgO和气体,
(1)为了加快菱镁矿的溶解,在酸溶阶段可以采取的措施有:增大酸浓度、增大反应物接触面积、加热、搅拌等;MgCO3与稀硫酸反应生成硫酸镁和二氧化碳、水;
(2)双氧水具有氧化性,亚铁离子具有还原性,所以双氧水能氧化亚铁离子生成铁离子;
(3)滤渣2 的成分是氢氧化铁;
滤液A的主要成分有硫酸镁、一水合氨、硫酸铵;
(4)根据盖斯定律计算反应热.
解答 解:菱锰矿中加入稀硫酸,发生的反应为MgCO3+H2SO4=MgSO4+CO2↑+H2O、FeCO3+H2SO4=FeSO4+H2O+CO2↑,然后过滤得到滤渣1和溶液,向溶液中加入双氧水,亚铁离子被氧化生成铁离子,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,向溶液中加入氨水,并调节溶液的pH为4左右,发生的离子反应为Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+,铁离子转化为沉淀,然后过滤得到滤渣2为Fe(OH)3,经过一系列操作最后和木炭煅烧得到MgO和气体,
(1)为了加快菱镁矿的溶解,在酸溶阶段可以采取的措施有:增大酸浓度、增大反应物接触面积而将菱锰矿粉碎、加热、搅拌等;MgCO3与稀硫酸反应生成硫酸镁和二氧化碳、水,离子方程式为,
故答案为:增大酸浓度、搅拌、加热、粉碎固体(任写一种);MgCO3+2H+═Mg2++CO2↑+H2O;
(2)双氧水具有氧化性,亚铁离子具有还原性,所以双氧水能氧化亚铁离子生成铁离子,离子方程式为,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)通过以上分析知,滤渣2 的成分是Fe(OH)3;
滤液A中有硫酸和氨水生成的硫酸铵、过量的一水合氨、硫酸镁,所以A的主要成分有(NH4)2SO4、NH3.H2O、MgSO4,故答案为:(NH4)2SO4、NH3.H2O、MgSO4;
(4)根据盖斯定律,2MgSO4(s)+C(s)═2MgO(s)+2SO2(g)+CO2(g)△H1①
MgSO4(s)+C(s)═MgO(s)+SO2(g)+CO(g)△H2②
将方程式2②-①得CO2(g)+C(s)═2CO(g)△H═2△H2-△H1,
故答案为:2△H2-△H1.
点评 本题考查物质分离和提纯,涉及氧化还原反应、实验基本操作、离子方程式的书写、盖斯定律、反应速率影响因素等知识点,综合性较强,侧重考查基本操作、基本原理,明确流程图中发生的反应、基本操作方法、物质性质是解本题关键,难点是确定各物质中成分,题目难度中等.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中一定含有NH${\;}_{4}^{+}$ | |
| B. | 该溶液中一定含有硝酸根离子 | |
| C. | 该溶液中一定含有SO${\;}_{4}^{2-}$ | |
| D. | 根据上述实验不能确定Na+是否存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式: | B. | 丙烷分子的比例模型: | ||
| C. | 2-乙基-1,3-丁二烯分子的键线: | D. | 四氯化碳分子的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | V | |||
| X | W |
| A. | 原子半径:X>Y>V>W | |
| B. | X、W的质子数之和与最外层电子数之和的比值为 2:1 | |
| C. | 甲、乙混合时所生成的白烟为离子化合物,但其中含有共价键 | |
| D. | 在足量的沸水中滴入含有16.25 g ZW3的溶液可得到0.1 mol Z(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
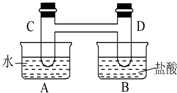 如图所示,在容器A中装有20℃的水50mL,容器B中装有1 mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:
如图所示,在容器A中装有20℃的水50mL,容器B中装有1 mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com