
【题目】高铁、移动支付、共享单车、网购,被称为中国“新四大发明”。用于高铁和共享单车制造业的重要金属材料是( )

A.Na﹣K合金B.Cu﹣Sn合金C.Sn﹣Pb合金D.Mg﹣Al合金
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、Q是原子序数依次增大的前20号元素。X2是通常状况下密度最小的气体;Z与R同主族,R的一种固体单质在空气中易自燃;Y、W最外层电子数之和是Z的2倍,W有W2、W3两种常见单质;含Q的化合物焰色反应呈紫色。请回答下列问题:
(1)X、W、R、Q原子半径由大到小的顺序是(写元素符号)__________;请写出Z在周期表中的位置____________________。
(2)由上述元素组成的物质YW(ZX2)2是一种中性肥料,请写出它的电子式______________。
(3)请设计实验比较Z与R元素的非金属性强弱____________________。
(4)X、Y形成的化合物中含有非极性键且相对分子质量最小的物质是________。(写化学式)
(5)R的简单氢化物具有强还原性,将其通入硫酸铜溶液能生成两种最高价含氧酸和一种单质,请写出该反应的化学方程式__________________________________________________。
(6)Y的最高价氧化物与Q的最高价氧化物的水化物按物质的量之比1:2反应,所得溶液中离子浓度由大到小的顺序____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯中存在如下平衡:Cl2(g) Cl2(aq)、Cl2(aq)+H2O H++Cl-+HClO。下列说法正确的是( )
A.向饱和氯水中通入HCl,有c(H+)=c(Cl-)+c(OH-)+c(ClO-)
B.向氯水中滴入几滴石蕊试液,溶液变红色
C.光照后的氯水漂白性增强
D.若向饱和氯水中通入少量SO2,则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取的工艺流程图如下:
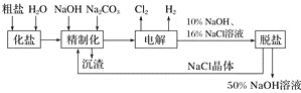
(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为______________,与电源负极相连的电极上所发生反应的电极反应式为__________________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为________________________________________________________________________。
(3)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该钡试剂可以是______(填字母)。
,该钡试剂可以是______(填字母)。
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为________。
,加入试剂的合理顺序为________。
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、结晶、________(填写操作名称)除去NaCl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填字母)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是______________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是__________________________________________________。
②让反应停止的操作方法及原因是_______________________________________________。
(4)以下收集NO气体的装置,合理的是________(填字母)。
a. b.
b.![]() c.
c. d.
d.![]() e.
e.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,稀释0.1 mol·L-1Na2CO3溶液,图中的纵坐标可以表示
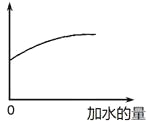
A. CO32-水解的平衡常数
B. 溶液的pH
C. 溶液中HCO3-的数目
D. 溶液中的c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如表:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中,正确的是( )
A. 向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B. 四种溶液中,水的电离程度最大的是NaClO
C. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D. NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
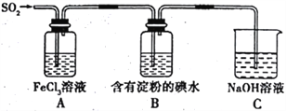
A. A装置中FeCl3溶液逐渐变为浅绿色,可以说明SO2有还原性
B. B装置中蓝色退去,说明还原性:SO2>I-
C. C装置中吸收尾气有可能倒吸
D. A、B装置中发生的反应转移电子数一定相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中投入一定量的A和B发生反应:mA(g)+nB(g)![]() pC(g)+qD(g)。
pC(g)+qD(g)。
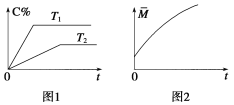
(1)若开始时加入A物质m mol,欲使A与B的转化率相等,则加入B物质________mol。
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如图1所示。则T1(填“>”、“<”或“=”)______T2,该反应正反应方向的ΔH(填“>”、“<”或“=”)______0。
(3)一定条件下,从正反应开始至达到化学平衡的过程中,混合气体的平均相对分子质量随时间的变化如图2所示,测得达到平衡时A、B、C、D的物质的量均为1 mol。
①若在恒温恒容的条件下,向该平衡体系中再通入A、B、C、D各1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”)__________。
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com