
下图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:
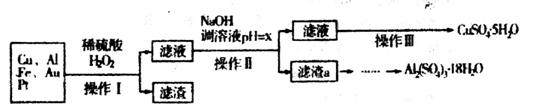
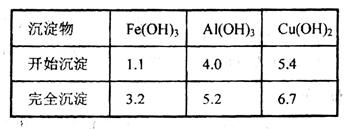
已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式______________。
(2)在操作II中,x的取值范围是___________________。
(3)在操作III中,蒸发浓缩需要的玻璃仪器有______________________________________。
(4)由滤渣a制取Al2(SO4)3•18H2O,探究小组设计了三种方案:
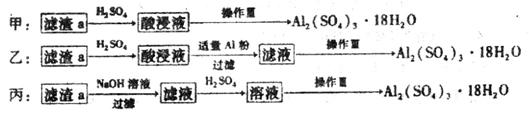
综合考虑上述三种方案,最具可行性的是___________(填序号)。
(5)为测定CuSO4•5H2O晶体的纯度,进行下列实验:取a g 试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol/LEDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL,CuSO4•5H2O晶体的纯度是_________。
【答案】(1)Cu+H2O2+H2SO4=CuSO4+2H2O(2分) (2)[5.2,5.4) (2分)
(3)玻璃棒 酒精灯 (烧杯)(2分) (4)乙 (2分) (5)15b/a×100%(2分)
【解析】
试题分析:(1)双氧水具有氧化性,在稀硫酸溶液中将铜氧化为硫酸铜,方程式为Cu+H2O2+H2SO4=CuSO4+2H2O。
(2)依据图表数据分析可知,溶液pH调节为5.2~5.4,使Fe3+和Al3+形成沉淀,铜离子不沉淀。
(3)蒸发浓缩需要的玻璃仪器是玻璃棒、酒精灯(烧杯)。
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费;
(5)取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液12mL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+。铜离子物质的量和标准液物质的量相同=bmol/L×0.012L=0.012bmol;依据元素守恒得到:则20ml溶液中含有的CuSO4•5H2O物质的量为0.012bmol;100ml溶液中含0.012bmol×5=0.06bmol;所以CuSO4•5H2O质量分数的表达式=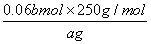 ×100%=
×100%=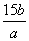 ×100%。
×100%。
考点:考查离子分离的方法,实验设计,仪器和试剂选择,中和滴定的简单计算等


科目:高中化学 来源: 题型:
25 ℃时,将一定量的冰醋酸(无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示。
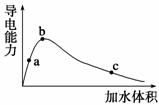
请完成下列问题:
(1)上述a、b、c三点对应醋酸的电离程度最大的是 (填“a”、“b”、“c”),三点对应溶液中c(OH-)由大到小的顺序为 。
(2)c点对应的溶液中c(H+)与c(CH3COO-)+c(OH-)的关系为前者 (填“大于”“小于”“等于”)后者。
(3)从a点到b点,溶液中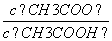 的比值 (填“增大”、“减小”、“等于”)。
的比值 (填“增大”、“减小”、“等于”)。
(4)25 ℃时,体积均为100 mL 、pH=m的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示。则稀释前两溶液中c(OH-)= , HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
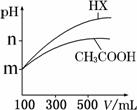
(5)若用pH试纸进行实验,你能否区分上述HX和CH3COOH两种酸溶液?若能,请简述操作过程;若不能,请说明理由。 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题。
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母) 。
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | | | | | | |
| 序号 | a | b | c | d | e | f |
(3)下列情况会使所配溶液浓度偏低的是(填序号)
①称量时,左盘高,右盘低
②固体溶解后未冷却到室温就直接转移到容量瓶中
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
(4)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示:
L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示:
 |
①当加入35.0mL盐酸溶液时,产生标准状况下二氧化碳的体积为__________mL;
②计算所取氢氧化钠溶液的体积V=__________mL。
(5)取上述氢氧化钠溶液200mL,加入适量铝粉使之恰好完全反应,该反应的化学方程式为__________________________________,逐渐向反应后的溶液中至少加入1.0 mol L-1的盐酸________ mL才能使生成的沉淀完全溶解。
L-1的盐酸________ mL才能使生成的沉淀完全溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式
①I2(g)+H2(g) 2HI(g)△H=-9.48kJ/mol
2HI(g)△H=-9.48kJ/mol
②I2(s)+H2(g) 2HI(g)△H=+26.48kJ/mol
2HI(g)△H=+26.48kJ/mol
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向l00 mL 0.01 mol/LHA溶液中逐滴加入0.02 mol/LMOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,正确的是
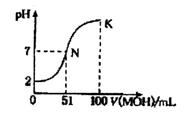
A.HA为一元强酸,MOH为一元强碱
B.K点所示溶液中c(A-)>c(M+)
C.N点水的电离程度小于K点水的电离程度
D.K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol·L-1的下列物质的水溶液,从常温加热到90 ℃,溶液的pH几乎不变的是(不考虑水的蒸发)( )
A.氯化钠 B.氢氧化钾 C.硫酸 D.硫酸铵
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)  CH3OH(g);ΔH<0。第 2 min 时只改变一个条件,反应情况如下表:
CH3OH(g);ΔH<0。第 2 min 时只改变一个条件,反应情况如下表:
| 时间 | c(CO)/mol·L-1 | c(H2)/mol·L-1 | c(CH3OH)/mol·L-1 |
| 起始 | 1 | 3 | 0 |
| 第2 min | 0.8 | 2.6 | 0.2 |
| 第4 min | 0.4 | 1.8 | 0.6 |
| 第6 min | 0.4 | 1.8 | 0.6 |
下列说法不正确的是( )
A.第4 min至第6 min该化学反应处于平衡状态
B.第2 min时,如果只改变某一条件,则改变的条件可能是降低温度
C.第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂
D.第6 min时,其他条件不变,如果升高温度,正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. SO3 、NH3的水溶液均能导电,所以均是电解质
B. 蔗糖、酒精在水溶液中和熔融态时均不导电,所以它们是非电解质
C. 液态硫酸、固态硫酸钡不能导电 ,所以二者均不是电解质
D. 钢铁、石墨均导电,所以它们是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关系中,A是一种正盐,D的分子量比C的分子量大16,E是酸;当X无论是强碱还是强酸时都有如下转化关系:
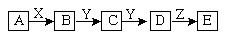
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强酸时,A、B、C、D、E均同时含有另一种元素。回答下列问题:(用化学式填写)
(1)A是_____________,Y是______________,Z是____________。
(2)当X是强碱时,写出B与Y反应的化学方程式:___________________________。
(3)当X是强酸时,写出C与Y反应的化学方程式:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com