
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 氯化硼中心原子采用sp杂化 | |
| C. | 三氯化硼遇水蒸气会产生白雾 | |
| D. | 氯化硼分子呈平面正三角形,属非极性分子 |
分析 A.氯化硼是共价化合物;
B.三氯化硼中的硼为sp2杂化;
C.三氯化硼水解生成HCl;
D.三氯化硼中的硼为sp2杂化,无孤对电子.
解答 解:A.氯化硼是共价化合物液态时不能导电,故A错误;
B.三氯化硼中的硼为sp2杂化,无孤对电子,故B错误;
C.三氯化硼水解生成的HCl在空气中形成白雾,故C正确;
D.三氯化硼中的硼为sp2杂化,无孤对电子,分子中键与键之间的夹角为120°,是平面三角形结构,属非极性分子,故D正确.
故选CD.
点评 本题考查原子轨道杂化,分子立体构型等,难度适中,注意三氯化硼中的硼为sp2杂化,无孤对电子,分子中键与键之间的夹角为120°,是平面三角形结构.


科目:高中化学 来源: 题型:选择题

| A. | 溴化银应避光保存 | |
| B. | 变色镜片可反复变色 | |
| C. | 变色镜片颜色变深的过程发生了化合反应 | |
| D. | 变色镜片中的氧化铜在变色过程中质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙醇(C2H5OH)是一种重要的有机物.
乙醇(C2H5OH)是一种重要的有机物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2010年11月12日至27日,中国广州成功举办了第16届亚运会,中国代表团共获得了199枚金牌.为保证比赛成绩的公正、公平,反兴奋剂是一项重要而艰巨的工作.某种兴奋剂的结构简式如图所示.有关该物质的说法错误的是( )
2010年11月12日至27日,中国广州成功举办了第16届亚运会,中国代表团共获得了199枚金牌.为保证比赛成绩的公正、公平,反兴奋剂是一项重要而艰巨的工作.某种兴奋剂的结构简式如图所示.有关该物质的说法错误的是( )| A. | 该有机物能与FeCl3溶液发生显色反应 | |
| B. | 一定条件下1mol该物质能与7molH2发生加成反应 | |
| C. | 该有机物分子中所有的原子不可能在同一平面 | |
| D. | 该有机物是苯酚的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能等于7 | B. | 一定<7 | C. | 一定>7 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该分子中官能团的名称为羧基、羟基,可以和醇类物质发生酯化(或取代)反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为HOOC-CH=CH-COOH.
,该分子中官能团的名称为羧基、羟基,可以和醇类物质发生酯化(或取代)反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为HOOC-CH=CH-COOH.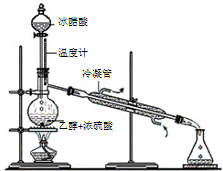

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com