
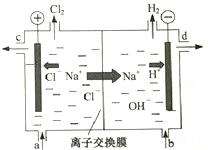
 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:分析 (1)电解精制饱和食盐水生成氯气、氢气、烧碱;
(2)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;H2、NaOH在阴极,NaOH溶液的出口为d,Cl2在阳极,精制饱和食盐水从阳极进入;
(3)H2SO3K1=1.54×10-2,K2=1.02×10-7,HClO K1=2.95×10-8 ,说明ClO-水解程度大于SO32-;
H2SO3 K1=1.54×10-2 K2=1.02×10-7,H2CO3K1=4.3×10-7K2=5.6×10-11.说明SO32-水解程度小于CO32-.
解答 解:(1)电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑,
故答案为:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;
(2)电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即进口为a,
故答案为:a,d;
(3)H2SO3 K1=1.54×10-2,K2=1.02×10-7,HClOK1=2.95×10-8 ,说明ClO-水解程度大于SO32-,0.1mol/L NaClO溶液的pH大于0.1mol/L Na2SO3溶液的pH,依据电离平衡常数大小比较,H2SO3K1=1.54×10-2 K2=1.02×10-7,H2CO3K1=4.3×10-7K2=5.6×10-11.说明SO32-水解程度小于CO32-,浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-),
故答案为:大于;c(SO32-)>c( CO32- )>c(HCO3-)>c(HSO3-).
点评 本题考查了氯碱工业有关知识,涉及电极分析判断方法,化学方程式书写,主要是弱电解质电离程度大小和盐类水解的原理应用,离子浓度大小比较,题目难度中等.


科目:高中化学 来源: 题型:解答题
 结合Na、Al、Fe的有关性质,回答下列问题.
结合Na、Al、Fe的有关性质,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:W>X>Y>Z | B. | 原子半径:W>X>Y>Z | ||
| C. | W的最高价氢氧化物的碱性比X弱 | D. | Y的最简单氢化物的稳定性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制饱和氯水中:Na+、Al3+、SO32-、SO42- | |
| B. | 加入铝粉能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| C. | 常温下,在碱性的溶液中:K+、AlO2-、CO32-、Na+ | |
| D. | 在碱性的溶液中:K+、NH4+、AlO2-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 化学式为C9H10O2的有机物A有如下的转化关系
化学式为C9H10O2的有机物A有如下的转化关系
 ,H:CH3COOCH=CH2
,H:CH3COOCH=CH2
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰氧化钙可用作食品的防氧化剂 | |
| B. | P2O5不可用作食品干燥剂 | |
| C. | 无水硅胶可用作食品干燥剂 | |
| D. | 加工后具有吸水性的植物纤维可用作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中常用的塑料制品及橡胶制品都为高分子材料 | |
| B. | 向牛奶中加入果汁会产生沉淀,这是因为酸碱发生了中和反应 | |
| C. | 节日焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在7.8gNa2O2晶体中阳离子与阴离子总数为0.3NA | |
| B. | 在KIO3+6HI=KI+3I2+3H2O反应中,每生成3mol I2,则转移6NA个电子 | |
| C. | 1mol Na2O2与H2O完全反应,转移的电子总数为NA | |
| D. | 在1L0.1mol/L的碳酸钠溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将分别蘸有浓硝酸和浓氨水的玻璃棒相互靠近时,有白烟生成 | |
| B. | 硝酸具有酸的通性,如果与活泼金属反应,会有H2生成 | |
| C. | 浓硝酸能使活泼金属如铝、镁、锌、铁等发生“钝化” | |
| D. | 常温下,铜与稀HNO3反应很慢,是因为发生了“钝化” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com