
【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为_______。
(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是______ (用元素符号表示)
(3)As4O6的分子结构如左下图所示,其中As原子的杂化方式为______________,1 mol As406含有σ键的物质的量为_______。


(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右上图所示。则Y轴可表示的氢化物(RH3)性质可能是__________。
A.稳定性 B.沸点 C.R-H键能 D.分子间作用力
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是_____________________
(6)NH4+中的H—N—H的键角比 NH3中的H—N—H的键角_______(填”大”或”小”),原因是_______________________________________________
【答案】 [Ar]3d104s24p3 N>As>Ga sp3 12mol AC NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键 大 NH4+中无孤电子对,而NH3中有一对孤电子对,对成键电子对的斥力大,导致NH3中的键角小于NH4+
【解析】(1)砷是33号元素,所以基态As原子的核外电子排布式为[Ar]3d104s24p3 。
(2)同一周期元素原子序数越大,电负性越大;同一主族元素,原子序数越小,电负性越大。镓、氮、砷这3种元素中,氮和砷是第VA族元素,氮的非金属性较强,所以氮的电负性较大;砷和镓都是第4周期元素,镓是31号元素,所以的电负性由大至小的顺序是N>As>Ga
(3)看图可知,As4O6的分子中每个砷原子与邻近的3个O原子形成σ键,每个砷原子还有一个孤电子对,所以As原子的杂化方式为sp3;每 个As4O6分子中有12个σ键,所以1 mol As406含有σ键的物质的量为12mol。
(4)同一主族元素的气态氢化物,非金属性越强的越稳定,其分子内的共价键的键能越大,所以Y轴可表示的氢化物(RH3)性质可能是AC。
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键。
(6)根据价层电子对互斥理论,孤电子对对成键电子对的斥力更大。由于NH4+中无孤电子对,而NH3中有一对孤电子对,对成键电子对的斥力大,导致NH3中的键角小于NH4+。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的试剂或方法不正确的是
A. Na2CO3粉末(NaHCO3),加热直至固体质量不再减少
B. NaHCO3溶液(Na2CO3),向溶液中通入过量的CO2气体
C. CO2(HCl),将气体依次通过Na2CO3溶液和浓硫酸中
D. H2(HCl),将气体通入碱石灰中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1 mol / L的①NaHCO3、②Na2CO3、③NaCl、④NaHSO4四种溶液,按pH值由小到大排列的顺序是
A. ①②③④ B.④③①② C.③④①② D.②①④③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )

提示:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
A. 加入Na2SO4可以使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
I. 写出下列物质或微粒的电子式:
(1)CO2_________________
(2)N2__________________
(3) Na2O_____________
(4)NaOH________________
II. 下列物质:①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧ I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答)_____________
含有共价键的共价化合物是(用序号回答)_______________
(2)当其熔化时,不破坏化学键的是(用序号回答)______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在特定条件下一定能够大量共存的是
A. 含有较多Fe3+的溶液:Na+、SO42-、HS-、NH4+
B. c(OH-)=1mol/L的溶液:AlO2-、CH3COO-、K+、Ba2+
C. pH=1的溶液:K+、Fe2+、NO3-、Na+
D. 遇Al能放出H2的溶液:HCO3-、K+、Mg2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“焰色反应”的理解和应用不正确的是
A.可用光洁无锈的铁丝替代铂丝作焰色反应实验
B.实验完成后铂丝用盐酸洗净,在外焰上灼烧至没有颜色时再使用
C.只有某些金属或其化合物才有焰色反应
D.用焰色反应鉴别NaCl、KCl和K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向盛有60mL pH=4 HA溶液的绝热容器中加入pH=13的NaOH溶液,所得混合溶液的温度(T)与加入NaOH溶液体积(V)的关系如图所示。下列叙述不正确的是

A. HA溶液的物质的量浓度为0.067mol·L-1
B. 25℃时,HA的电离平衡常数约为1.5×10-9
C. a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. b点时:c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)中学实验常用如图所示装置制取少量溴苯。在烧瓶a中装的试剂是苯、溴和铁粉。请填写下列空白。
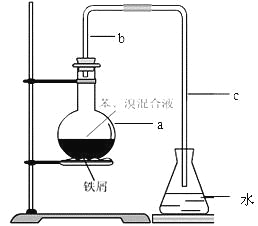
⑴导管b的作用有两个:一是导气,二是兼起 的作用;
⑵a中反应的化学方程式为 ;
⑶该实验得到的是粗苯,为了除去其中的溴,要用到的一种常用除杂操作方法是 ,提纯溴苯的具体步骤有:
①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗;⑤水洗 。
正确的操作顺序为( )
A.①②③④⑤ | B.②④⑤③① | C.④②③①⑤ | D.②④①⑤③ |
⑷为证明苯和溴发生的是取代反应而不是加成反应,可向水中加入 ;但该实验不够严密,为此必须在导管a、b之间加上一盛有 的洗气瓶,目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com