
科目:高中化学 来源: 题型:选择题
| 晶体 | NaCl | KCl | AlCl3 | SiCl4 | 单质B |
| 熔点/℃ | 810 | 776 | 190 | -68 | 2300 |
| 沸点/℃ | 1465 | 1418 | 180 | 57 | 2500 |
| A. | SiCl4是分子晶体 | B. | 单质B可能是原子晶体 | ||
| C. | AlCl3加热能升华 | D. | NaCl中化学键的强度比KCl中的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
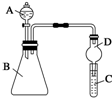 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素的性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为固态,其氢化物的化学式为RH4 |
| Z | 第三周期的简单离子中半径最小 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
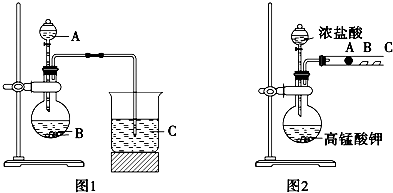
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
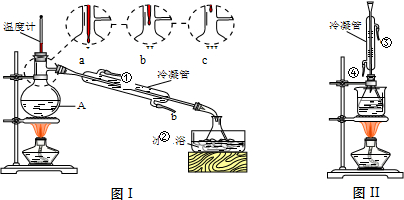
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com