
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 0.1 mol NaHSO4固体中含有的离子总数为0.3NA
B. 1L 1 mo1·L-1的(NH4)2CO3溶液中所含NH4+的数目为2NA
C. 标况下,22.4L Cl2通入水中,转移的电子数为NA
D. 20g D2O含有的中子数为10NA
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】已知25℃时,醋酸溶液中存在下述关系:![]()
(1)当向该溶液中加入一定量盐酸时,上式中的数值是否发生变化_________ ?为什么_________?
(2)若醋酸的起始浓度为0.010 mol L-1,平衡时c(H+)是多少_________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨水的叙述正确的是( )
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1mol·L-1的氨水指在1L溶液中含NH3、NH3·H2O、NH4+物质的量之和为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B. [实验化学]
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:

已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
苯胺 | -6℃ | 184.4℃ | 3.4 |
醋酸 | 16.6℃ | 118℃ | 易溶 |
实验步骤如下:
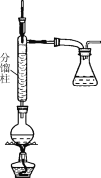
步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照如图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
(1)步骤1中加入锌粉的作用是________。
(2)步骤2中控制温度计示数约105℃的原因是________。
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是__________________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种高效除草剂,其合成路线流程图如下:
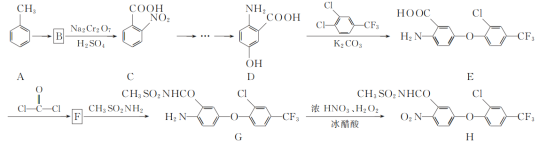
(1)E中含氧官能团名称为________和________。
(2)A→B的反应类型为________。
(3)写出同时满足下列条件的D的一种同分异构体的结构简式:________。
①不能发生水解反应,能与FeCl3溶液发生显色反应:
②分子中有4种不同化学环境的氢。
(4)F的分子式为C15H7ClF3NO4,写出F的结构简式:________。
(5)已知:—NH2与苯环相连时,易被氧化;—COOH与苯环相连时,再引入其他基团主要进入它的间位。请写出以A和D为原料制备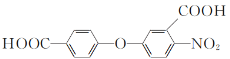 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物可实现苯酚(![]() )废水的净化,装置如图所示。下列有关说法正确的是
)废水的净化,装置如图所示。下列有关说法正确的是
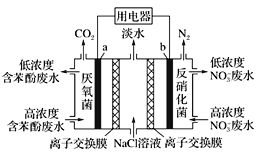
A. a极的电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
B. b极为正极,发生氧化反应
C. 中间室的Na+向左室移动
D. 右室生成0.1 mol N2时,用电器流过0.5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过量排放含氮物质会污染大气或水体,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
Ⅰ.对NO与O2反应的研究。
(1)已知氮氧化物转化过程中的焓的变化如下图所示,写出 NO转化为NO2的热化学方程式__________。
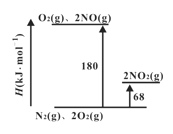
(2)2NO+O2![]() 2NO2的平衡常数表达式K=_______。其他条件不变,利用分子捕获器适当减少反应容器中NO2的含量,平衡常数K将_____(填“增大”、“减小”或“不变” )。
2NO2的平衡常数表达式K=_______。其他条件不变,利用分子捕获器适当减少反应容器中NO2的含量,平衡常数K将_____(填“增大”、“减小”或“不变” )。
(3)已知:2NO2(g)![]() N2O4(g) △H<0。在一定条件下,将2 mol NO和1 mol O2通入恒容密闭容器中进行反应,在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如下图所示。
N2O4(g) △H<0。在一定条件下,将2 mol NO和1 mol O2通入恒容密闭容器中进行反应,在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如下图所示。

①曲线c代表________的物质的量与温度的关系,x点对应的O2的转化率为________。
②根据上图可推测_________________。
A.2NO+O2![]() 2NO2的平衡常数:x点﹥y点
2NO2的平衡常数:x点﹥y点
B.y点时2NO+O2![]() 2NO2的反应速率:υ(正)﹤υ(逆)
2NO2的反应速率:υ(正)﹤υ(逆)
C.400~1200℃时,随着温度升高,N2O4体积分数不断增大
D.x点对应的NO的物质的量分数为4/11
Ⅱ.对废水中过量氨氮转化的研究。
废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。某科研小组用NaClO氧化法处理氨氮废水,将其转化为无污染物质,不同进水pH对氨氮去除率的影响如图所示。
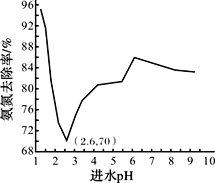
已知:ⅰ.HClO的氧化性比NaClO强;
ⅱ.NH3比NH4+更易被氧化。
(4)pH=1.25时,NaClO与NH4+反应生成N2等无污染物质,该反应的离子方程式______。
(5)进水pH为1.25~6.00范围内,氨氮去除率随pH升高发生图中变化的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:

①已知相关反应的能量变化如图所示:

过程Ⅰ的热化学方程式为________。
②关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
③其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是________。
(2)在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g)。

①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________(kPa)2。(用各物质的分压代替物质的量浓度计算)
(3)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中![]() ,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液,经测定含有Al3+、Br-、SO42-,且各离子物质的量浓度相等(不考虑水电离出来的H+和OH-),则对该溶液的说法合理的是( )
A.可能含有![]() B.可能含有
B.可能含有![]() C.一定含有
C.一定含有![]() D.至少含有四种离子
D.至少含有四种离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com