
| A. | 因为反应物浓度越大,反应速率越快,所以常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 | |
| B. | 增大反应物浓度可加快反应速度,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| C. | 对化学反应速率起决定性作用的因素是参加反应的各物质的性质 | |
| D. | 化学反应速率也可以用单位时间内固体物质的消耗量或者气体物质的生成量来表示 |
分析 A.浓硝酸和铝发生钝化现象;
B.浓硫酸和铁发生钝化现象,且浓硫酸和铁反应不生成氢气;
C.化学反应速率取决于物质本身的性质;
D.化学反应速率常用单位时间内任何一种反应物物质的量浓度的减小或生成物物质的量浓度的增加来表示.
解答 解:A.常温下,浓硝酸和Al发生钝化现象阻止进一步反应,所以稀硝酸中铝片先溶解完,故A错误;
B.常温下,浓硫酸和铁发生钝化现象而阻止进一步反应,且浓硫酸和Fe反应生成SO2而不是H2,故B错误;
C.化学反应速率取决于物质本身的性质,外界条件只是影响因素,故C正确;
D.化学反应速率常用单位时间内任何一种反应物物质的量浓度的减小或生成物物质的量浓度的增加来表示,固体和纯液体没有浓度而言,故D错误;
故选C.
点评 本题考查化学反应速率影响因素,浓度、温度、催化剂、压强(仅适用于有气体参加的反应)等都影响反应速率,但不是反应速率快慢的决定因素,易错选项是AB.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
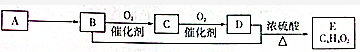
| A. | B中含有的官能团为羟基 | B. | 可用碳酸钠溶液区别B、D | ||
| C. | D中含有C═O键,E的名称为乙酸乙酯 | D. | B+D→E反应的装置如图 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的硝化、乙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 | |
| B. | 蛋白质、淀粉、油脂等都能在人体内水解并提供能量 | |
| C. | 乙烯、苯、乙烷分子中的所有原子都在同一平面上 | |
| D. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. Al(OH)3+3H+(用离子方程式表示).
Al(OH)3+3H+(用离子方程式表示).| X | ||||
| Y | Z | W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com