
【题目】某兴趣小组甲设计了以下装置和方法测定空气中SO2含量.你认为可行的操作是
序号 | A | B | C |
装置 |
|
|
|
原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
【答案】B
【解析】解:A.二氧化硫与氯化钡溶液不反应,把含有二氧化硫的空气通入氯化钡溶液中不能生成亚硫酸钡沉淀,所以不能求出二氧化硫的量,A不符合题意;
B.二氧化硫与KMnO4溶液反应,使溶液褪色,当KMnO4溶液刚好褪色时,二氧化硫与高锰酸钾恰好完全反应,根据消耗的高锰酸钾的物质的量可以求出二氧化硫的物质的量,进而能求出空气中SO2含量,B符合题意;
C.空气中的二氧化硫、二氧化碳、水蒸气均能被碱石灰吸收,把含有二氧化硫的空气通过碱石灰,碱石灰增加的质量为二氧化硫、二氧化碳和水蒸气的质量和,所以不能求出二氧化硫的量,C不符合题意.
根据二氧化硫的酸性、还原性、亚硫酸的酸性强弱等进行分析可能发生的反应,然后做出判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂排出的主要固体废物,我国火电厂粉煤灰的主要氧化物组成为SiO2、A12O3、Fe2O3、CaO、MgO等、利用粉煤灰可制备污水处理的混凝剂(PAFC)及其他化工产品,其下艺流在如下:
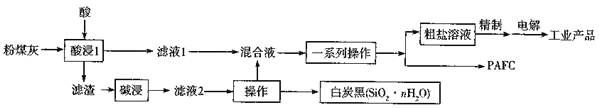
(1)PAFC名称是聚合氧化铝铁,其化学式为[Al2(OH)nCl6-n][Fe2(OH)NCl6-N]M,化学式中n、m、N、M均为整数。已知碱式氯化镁[Mg(OH)2·MgCl2],]可改写为氧化物和氯化物形式2MgO·2HCl,则PAFC改写为氧化物和氯化物形式为__________________。
(2)“酸浸”操作中加入的酸为_______(填字母)
a.稀硫酸 b.浓硫酸 c.稀盐酸 d.稀硝酸
为了提高“酸浸”速率,可采取的措施为___________________。(填两种即可)。
(3)“碱浸"用的是NaOH溶液。该反应的离子方程式为_______________。
(4)“粗盐溶液”“精制”后的“电解”操作中,阴极反应为________________。
(5)常温时,测得流程图中“粗盐溶液”中c(Ca2+)=c(Mg2+)=0.01mol/L,若溶液中阳离子的浓度为1.0×10-5mol/L时可认为该离子除去干净,则Mg2+除干净时的pH=___,此时Ca2+的浓度___。{忽略加入碱液所导致的溶液体积变化;Ksp[Ca(OH)2] =6.0×10-6,Ksp[Mg(OH)2]=2.0×10-11,1g2=0.31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应aA+bB=dD+eE,若已知40g A可恰好与21g B完全反应生成28g D,则B与E的摩尔质量比为
A.7a:10dB.10a:7dC.10b:7eD.7e:11b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。
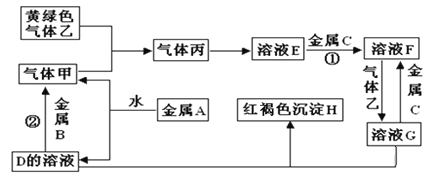
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:H_______________;乙______________。
(2)写出下列反应的离子方程式
反应①_________________________________________________________________
反应②_________________________________________________________________
(3)检验溶液G中的阳离子,可取少量溶液G于试管中,滴加KSCN溶液,现象是____________。检验溶液G中的阴离子,可另取少量溶液G于试管中,滴加__________(填化学式)溶液,现象是产生白色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子数≤18的A和M两种元素,已知A2﹣与M+的电子数之差为8,则下列说法正确的是( )
A.A和M原子的最外层电子数之差不一定为5
B.A和M原子的最外层电子数之和一定为7
C.A和M原子的电子数之差一定为11
D.A和M的原子序数之差不一定为5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
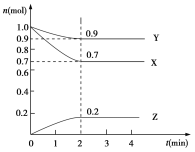
(1)起始时X的浓度为c(X)=________;反应从开始至2分钟末,Y的转化率为α(Y)=________;用Z的浓度变化表示的平均反应速率为v(Z)=________。
(2)由图中所给数据进行分析,该反应的化学方程式为______________________________。
(3)当反应进行到第___min,该反应达到平衡。此时,v(正)____v(逆) (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B均为短周期元素中的一种,已知A的原子序数为n,A2+离子比B2-离子少8个电子,则B的原子序数为
A. n+4B. n+6C. n+8D. n+10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表.
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10﹣2 mol/(Lmin)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10﹣2 mol/(Lmin)
C.反应到6 min时,H2O2分解了50%
D.反应到6 min时,c(H2O2)=0.30 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若把周期表原先的主、副族序号取消,由左到右按原顺序编为18列。如碱金属为第一列稀有气体为第18列,按这个规定,下列说法中不正确的是
A.第10列元素全部是金属元素
B.第18列元素单质全部是气体
C.只有第2列元素的原子最外层有2个电子
D.第3列元素种类数最多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com