
某500mL溶液中含0.1 mol Fe2+.0.2molFe3+,加入0.2mol铁粉,待Fe3+ 完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变) ( )
(提示:2 Fe3+ + Fe=3 Fe2+ )
A.0.4 mol/L B.0.6 mol/L C.0.8 mol/L D. l.0 mol/L
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
下列关于漂白粉的叙述正确的是( )
A.漂白粉的有效成分是Ca(ClO)2和CaCl2
B.漂白粉在空气中久置能变质
C.漂白粉是由Cl2与石灰乳制得的纯净物
D.漂白粉可用浓盐酸制得
查看答案和解析>>
科目:高中化学 来源: 题型:
依据元素周期表及元素周期律,下列推断正确的是
A.同一周期元素的原子,半径越小越容易失去电子
B.ⅠA族元素的金属性比ⅡA族元素的金属性强
C.若M+和R2-的核外电子层结构相同,则原子序数:R>M
D.主族元素的最高正化合价等于该元素原子的最外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知: Cu2O + 2H+ = Cu + Cu2+ + H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是 。
(2)反应Ⅰ完成后,铁元素的存在形式为 。(填离子符号)
请写出生成该离子的离子方程式 。
(3)x、y对应的数值范围分别是 、 。
(4)下列关于NaClO调pH的说法正确的是 。
a. 加入NaClO可使溶液的pH降低
b. NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,
HClO,
ClO-消耗H+,从而达到调节pH的目的
c .NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,
HClO+OH-,
OH-消耗H+ ,从而达到调节pH的目的
(5)用NaClO调pH,写出氯气制取漂白液的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用10mL的0.1 mol·L-1BaCl2溶液恰好使同体积的硫酸铁.硫酸锌和硫酸钾三种溶液中的SO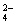 完全沉淀,则这三种溶液的物质的量浓度之比为( )
完全沉淀,则这三种溶液的物质的量浓度之比为( )
A.3:2:2 B.1:2:3 C.1:3:3 D.3:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在400 mL 2 mol·L-1的H2SO4溶液中,溶质的质量是________。此溶液中的H+的物质的量浓度为________,SO42-的物质的量浓度为________。
(2)在标准状况下,700 L NH3的物质的量为________,全部溶解在1 L水中,所得溶液中溶质的质量分数为________。如果该氨水的密度为0.85 g·cm-3,则氨水的体积为________,NH3的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子:①I-、ClO-、NO3-、H+ ;②K+、NH+4、HCO3-、OH-;
③SO32-、SO42-、Cl-、OH-;④Fe3+、Cu2+、SO42-、Cl-;
⑤H+、K+、AlO2-、HSO3-;⑥Ca2+、Na+、SO42-、CO32-。在水溶液中能大量共存的是:
A. ①和⑥ B. ③和④ C.②和⑤ D.①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
300C时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是
A. c(H+)•C(OH-)>10-14 B. C(Na+)=C(S2-)+C(HS-)+C(H2S)
C. c(OH-)= C(H+)+C(HS-)+2C(H2S) D. C(Na+)+C(H+)=C(OH-)+C(HS-)+2C(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、
Fe3+、CO32—、SO42—,现每次取100.00ml进行实验。
①第一份加入AgNO3溶液有沉淀产生。
②第二份加足量NaOH后加热,收集到气体0.896L(标准状态下)。
③第三份加足量BaCl2后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤干燥后,剩2.33g。
试回答有关问题:
⑴判断K+、Cl-是否存在?K+ ;Cl- (填下列序号)。
A.一定存在 B.可能存在 C.一定不存在
⑵肯定存在的离子的原溶液中的物质的量浓度分别为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com