
| A. | V=150 mL | B. | m1=14.6g | ||
| C. | 白色沉淀最大量为15.6g | D. | m2=10.2g |
分析 钠、铝共融物投入一定量的水中可发生:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,向其溶液中逐滴加入加入盐酸发生的反应为NaAlO2+HCl(少量)+H2O=Al(OH)3↓+NaCl,当盐酸体积为VmL时,Al(OH)3↓+3HCl=AlCl3+H2O,故最终溶液的溶质为NaCl和AlCl3,液蒸干灼烧得固体为NaCl和Al2O3,据此进行分析.
解答 解:A.当沉淀的量最大时,溶液中的溶质是NaCl,根据NaCl中钠离子和氯离子的关系得n(Na)=n(Cl)=0.1L×4mol•L-1=0.4mol,根据转移电子相等得n(Al)=$\frac{\frac{11.2L}{22.4L/mol}×2-0.4mol×1}{3}$=0.2mol,
根据铝原子守恒得n( Al(OH)3)=0.2mol,根据Al(OH)3↓+3HCl=AlCl3+H2O,知,需要盐酸的物质的量为0.6mol,则盐酸体积=$\frac{0.6mol}{4mol/L}$=150ml,故A正确;
B.通过以上分析知,n(Na)=0.4mol,n(Al)=0.2mol,所以m1=23g/mol×0.4mol+27g/mol×0.2mol=14.6g,故B正确;
C..通过以上分析知,n( Al(OH)3)=0.2mol,故m( Al(OH)3)=0.2mol×78g/mol=15.6g,故C正确;
D.m2为NaCl和Al2O3,根据元素守恒n(NaCl)=n(Na)=0.4mol,n(Al2O3)=$\frac{1}{2}$n( Al(OH)3)=0.2mol×$\frac{1}{2}$=0.1mol,故m2=m(NaCl)+m(Al2O3)=0.4mol×58.5g/mol+0.1mol×102g/mol=33.6g,故D错误;
故选D.
点评 本题考查了混合物的有关计算,明确反应过程中发生的反应是解本题关键,再根据原子守恒、方程式来分析解答,注意氯化铝溶液蒸干灼烧时得到固体是氧化铝,为易错点.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z形成的气态氢化物中稳定性最强的是H2Z | |
| B. | Y所在族的氢化物的沸点最高的是Y对应的氢化物 | |
| C. | 离子半径的大小:M>Y>Z | |
| D. | M的最高价氧化物对应的水化物可以溶解于Y对应最高价含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
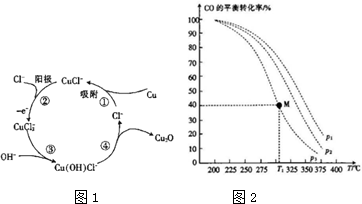
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ①②④ | C. | ②③ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
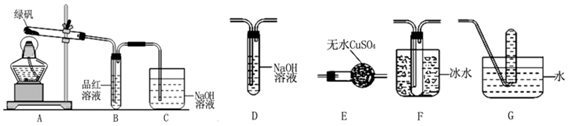
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
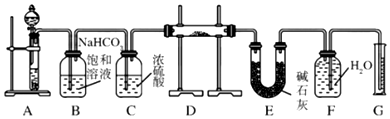
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
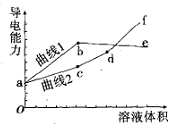 分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )
分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )| A. | 曲线2 代表滴加NH3•H2O溶液的变化曲线 | |
| B. | b和d点对应的溶液均显碱性 | |
| C. | b点溶液中c(NH4+ )>c(SO42- )>c(H+ )>c(OH- ) | |
| D. | df段导电能力升高的原因是发生了反应Al(OH)3+OH-═[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com