
| A. | 1 L该溶液中含溶质98 g | |
| B. | 从10 mL该溶液中取出5 mL后,剩余溶液的浓度不变 | |
| C. | 将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中充分溶解就可配得该浓度的硫酸溶液 | |
| D. | 该浓度的硫酸具有酸的通性 |
分析 A.1mol/L的硫酸1L时其物质的量=1mol/L×1L=1mol,硫酸的质量=nM;
B.溶液浓度具有均一性,溶液浓度大小与溶液体积无关;
C.49g硫酸物质的量=$\frac{4.9g}{98g/mol}$=0.05mol,将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中,溶液体积大于50mL;
D.硫酸属于酸,具有酸的通性.
解答 解:A.1mol/L的硫酸1L时其物质的量=1mol/L×1L=1mol,硫酸的质量=nM=1mol×98g/mol=98g,故A正确;
B.溶液浓度具有均一性,溶液浓度大小与溶液体积无关,所以从10 mL该溶液中取出5 mL后,剩余溶液的浓度不变,故B正确;
C.49g硫酸物质的量=$\frac{4.9g}{98g/mol}$=0.05mol,将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中,溶液体积大于50mL,则配制溶液浓度小于1mol/L,故C错误;
D.硫酸属于酸,具有酸的通性,石蕊试液遇该硫酸变红色,该硫酸能和较活泼金属反应生成氢气,能和碱反应生成盐和水,故D正确;
故选C.
点评 本题考查物质的量浓度计算、酸的性质等知识点,侧重考查学生判断及计算能力,明确物质的量公式中各个物理量关系、溶液特点是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 通入稀有气体使压强增大,平衡将正向移动 | |
| B. | X的正反应速率是Y 的逆反应速率的$\frac{m}{n}$倍 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 增加X的物质的量,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
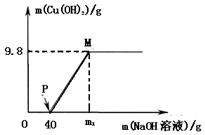 向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )
向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )| A. | 整个反应过程中,氯离子个数不变 | |
| B. | M点溶液中的溶质有一种 | |
| C. | P点溶液比M点溶液中氯化钠的质量分数大 | |
| D. | 沉沉完全时,m1的数值为120 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取11.72g食盐 | |
| B. | 用100mL的量筒量取25.00mL盐酸 | |
| C. | 用pH试纸测得某氯水的pH为4 | |
| D. | 用0.2000 mol/L盐酸滴定20.00mL未知浓度NaOH,用去22.40mL盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2═Ca2++Cl2 | B. | H2SO4═2 H++SO42- | ||
| C. | Ba(OH)2═Ba++2OH- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
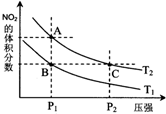 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com