
美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈V 形,如图所示(图中箭头代表单键)。下列有关该物质的说法中正确的是
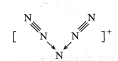
A. 每个Ns+中含有35个质子和36个电子 B. 该离子中只含有非极性键
C. 该离子中含有2个π键 D. N5+与PO43-互为等电子体
 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源:2016-2017学年江西省南昌市高二下学期第一次阶段性考试化学试卷(解析版) 题型:选择题
以下物质;① 甲烷;② 苯;③ 聚乙烯;④ 聚乙炔;⑤ 2-丁炔;⑥ 环己烷;⑦ 邻二甲苯;⑧ 苯乙烯。既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是
A.③④⑤⑧ B.④⑤⑦⑧ C.④⑤⑧ D.③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省北校高一3月月考化学试卷(解析版) 题型:选择题
原子序数为83的元素位于:①第5周期;②第6周期;③ⅣA族;④ⅤA族;⑤ⅡB族,其中正确的组合是( )。
A. ①④ B. ②③ C. ②④ D. ①⑤
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(二)化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. MgCO3可以除去MgCl2酸性溶液中的Fe3+
B. 实验测得NaHSO3溶液的pH<7,说明则H2SO3是强酸
C. 通过化学变化可以“点石成金”,即可将黏土转化成金单质
D. 2.24LNO与11.2O2充分反应所得气体中原子数目一定为0.3×6.02×1023
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:实验题
二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备 CeO2的一种工艺流程如下:

已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____________。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:____________;为避免产生上述污染,请提出一种解决方案:_____________。
(3)“萃取”时存在反应:Ce4+ +n(HA)2 Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(
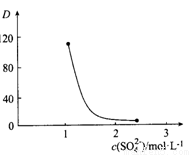
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(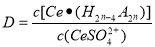 )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为__________。
(5)“氧化”步骤的化学方程式为_____________。
(6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
截止到2013年12月末,中国光伏发电新增装机容量达到10.66GW,光伏发电累计装机容量达到17.16GW,图为光伏并网发电装置电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。下列叙述中正确的是

A.N型半导体为正极,P型半导体为负极
B.制氢装置溶液中电子流向:从B极流向A极
C.X2为氧气
D.工作时,A极的电极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2 (g) +CO (g)  CH3OH (g)达到平衡。下列说法正确的是
CH3OH (g)达到平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度/mol.L-l | 物质的平衡浓度/mol.L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的逆反应放热
B. 达到平衡时,容器I中反应物转化率比容器II中的大
C. 达到平衡时,容器II中c(H2)大于容器III中c(H2)的两倍
D. 达到平衡时,容器III中的正反应速率比容器I中的大
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,1.12L CCl4含有的共价键数为0.2NA
B. 常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA
C. 过氧化钠与水反应时,生成0.lmol氧气转移的电子数为0.2NA
D. 常温下,0.1mol·L-1溶液中阴离子总数大于0.1NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省南宁市高一下学期第一次月考化学试卷(解析版) 题型:填空题
物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据图1和图2所示,回答下列问题:

图1
(1)Y的化学式为__________________
(2)欲制备Na2S2O3,从氧化还原角度分析,合理的是______________(填序号)。
a.Na2S +S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(3)将X与O2混合,可生成淡黄色固体。该反应的氧化剂与还原剂物质的量之比为_____________。
(4)图2为铜丝与W的浓溶液反应并验证其产物性质的实验装置。

图2
Ⅰ.①中反应的化学方程式是_____________。想要立即终止①的反应,最恰当的方法是__________。
a.上移铜丝,使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液
Ⅱ.④中棉花团的作用是_________________。
Ⅲ.反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com