
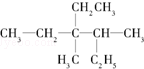
 用系统命名法命名:3,4-二甲基-3-乙基己烷.
用系统命名法命名:3,4-二甲基-3-乙基己烷. 分析 根据烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小,看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
解答 解:有机物 选取最长碳链为主碳链,含6个碳原子,离取代基近的一端编号,确定取代基的位置,用系统命名法命名得到名称为:3,4-二甲基-3-乙基己烷,
选取最长碳链为主碳链,含6个碳原子,离取代基近的一端编号,确定取代基的位置,用系统命名法命名得到名称为:3,4-二甲基-3-乙基己烷,
故答案为:3,4-二甲基-3-乙基己烷.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性知识的考查,侧重对学生基础知识的检验和训练.


科目:高中化学 来源: 题型:多选题
| A. | Na、Mg、Al的还原性逐渐减弱 | |
| B. | HCl、H2S、PH3、气态氢化物的稳定性逐渐增强 | |
| C. | NaOH、KOH的碱性逐渐增强 | |
| D. | O的原子半径比S的原子半径大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
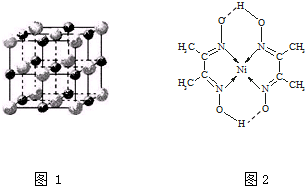 (1)已知A和B为第三周期元素,其原子的第一至第四电离能如表1所示:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表1所示:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
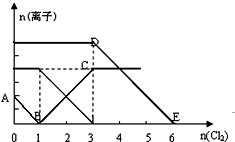 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )| A. | 线段BC代表Cl-数目的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2→2Fe3++I2+4 Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的烷烃,彼此都是同系物 | |
| B. | 两种化合物的组成元素相同,各元素的质量分数也相同,二者一定具有相同最简式 | |
| C. | 组成元素的质量分数相同的不同化合物互为同分异构体 | |
| D. | 互为同系物的有机物相对分子质量一定相差14的整数倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com