
关于如图所示各装置的叙述中,正确的
是
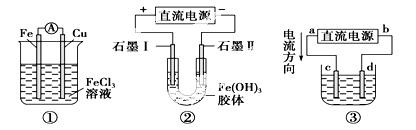
A.装置①是原电池,总反应是:Cu+2Fe3+===Cu2++2Fe2+
B.装置①中,铁作负极,电极反应式为:Fe3++e-===Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
200 mL 0.3 mol/L的K2SO4溶液和100 mL 0.2 mol/L的Fe2(SO4)3溶液混合后(不考虑混合后溶液体积的变化),溶液中SO 的物质的量浓度为( )
的物质的量浓度为( )
A.0.3 mol/L B.0.4 mol/L
C.0.45 mol/L D.0.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活密切相关,下列说法不正确的是
A.二氧化硫可广泛用于食品的漂白
B.葡萄糖可用于补钙药物的合成
C.聚乙烯塑料制品可用于食品的包装
D.次氯酸钠溶液可用于环境的消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
S2Cl2是工业上常用的硫化剂,实验室制备的方法有2种:
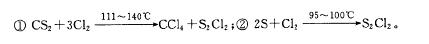 已知在S2Cl2中硫元素显+1价,电子式:
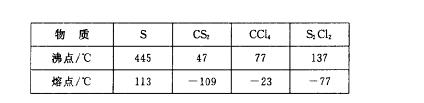
已知在S2Cl2中硫元素显+1价,电子式: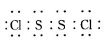 ,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
实验室利用下列装置制备 (部分夹持仪器已略去):
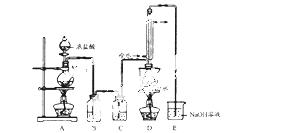
回答下列问题:
(1)写出A装置中发生反应的离子方程式_____________________________
(2)实验中盐酸通常采用36. 5%的浓溶液,不用稀盐酸的理由是____________________________
(3)D中冷凝管起到导气和冷凝回流双重作用。这种冷却装置可应用于下列高中化学中__________实验。
A.石油分馏 B.制备乙烯 C.制取乙酸乙酯 D.制取溴苯
(4)B装置中盛放的是___________,反应结束后从锥形瓶内混合物中分离出产品的方法是______,D中采用热水浴加热的原因是__________________
(5)A装置仪器装配时,整套装置装配完毕后,应先进行__________,再添加试剂。实验完毕,拆除装置时,应先将E中长导管移开液面,目的是_____________________________________
(6)实验过程中,若缺少C装置,则发现产品浑蚀不清,出现该现象的原因可用化学方程式表示为__________。实验完毕,当把剩余浓盐酸倒人E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是_______________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图所示装置进行实验,并回答下列问题:
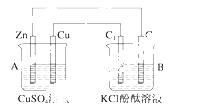
(1)判断装置的名称:A池为________,B池为______。
(2)锌极为______极,电极反应式为____________________________________;
铜极为______极,电极反应式为______________________________________;
石墨棒C1为____极,电极反应式为___________________________________;
石墨棒C2附近发生的实验现象为_____________________________________。
(3)当C2极析出224 mL气体(标准状况)时,锌的质量________(填“增加”或“减少”)______g,CuSO4溶液的质量________(填“增加”或“减少”)________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组用如图所示装置进行实验(电解液足量)。下列说法正确的是( )

A.图一中若开始实验时开关K与a连接,B极的电极反应式为Fe-3e-===Fe3+
B.图一中若开始实验时开关K与b连接,一段时间后向电解液中加适量稀盐酸可使电解液恢复到电解前的浓度
C.图二中若开始实验时开关K与a连接,电解液的浓度保持不变
D.图二中若开始实验时开关K与b连接,A极减少的质量等于B极增加的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是 ( )
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.铁管上镶嵌锌块,铁管不易被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
⑴工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)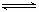 CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)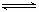 CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
⑵工业上可用CO和H2O (g) 来合成CO2 和H2,再利用⑴中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10 L固定密闭容器中进行化学反应:
L固定密闭容器中进行化学反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为 。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法 是 。
是 。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为 。
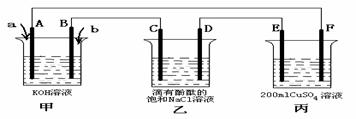
⑶甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变) ,当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:
① a物质是 , A电极的电极反应式为 。
② 乙装置中的总化学反应方程式为 。
③ 当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH= 。
 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com