
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.标况下,1mol水分子占有的体积为22.4L
B.17gOH-中质子总数比电子总数多NA
C.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-的数目为NA
D.4g氦气中所含氦原子的数目为NA
科目:高中化学 来源:2016-2017学年江苏省高一上期中化学试卷(解析版) 题型:选择题
完成下列实验所需选择的装置或仪器都正确的是
A | B | C | D | |
实验 | 分离植物油和氯化钠溶液 | 除去氯化钠晶体中混有的氯化钾晶体 | 分离CCl4中的Br2 | 除去CO2气体中的 |
装置 或仪器 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南郸城高级中学高二上第二次考试化学卷(解析版) 题型:填空题
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
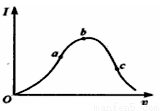
(1)“O”点导电能力为O的理由是 ;
(2)a、b、c三点溶液中c(H+)由小到大的顺序为 ;
(3)a、b、c三点中醋酸电离度最大的是 ;水电离程度最大的是 ;
(4)若使c点溶 液的c(CH3COO-)提高,在如下措施中可采取 (填标号)。
液的c(CH3COO-)提高,在如下措施中可采取 (填标号)。
A.加热
B.加盐酸
C.加冰醋酸
D.加入固体KOH
E.加水
F.加固体CH3COONa
G.加Zn粒
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南郸城高级中学高二上第二次考试化学卷(解析版) 题型:选择题
反应2A(g) 2B(g)+C(g)是放热反应,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是( )
2B(g)+C(g)是放热反应,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是( )
A.升温 B.增大反应器的体积 C.增大c(A) D.降温
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州贵阳花溪清华中学高一上月考一化学卷(解析版) 题型:实验题
按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
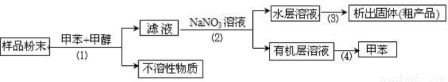
(1)从下图中选择与步骤(1)(2)(3)(4)分别对应的装置图________、________、________、________(填字母)
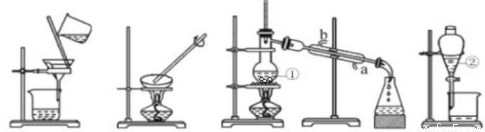
A B C D
(2)写出下列仪器的名称:①_________;②__________;①中沸石的作用为__________;
(3)冷凝水的进水方向:__________。(填“a”或“b”)
(4)下列能用装置D进行分离的是__________。
A.液溴和四氯化碳
B.乙醇和煤油
C.苯和蒸馏水
D.氯化钠和水
(5)装置A、B中玻璃棒的作用分别是__________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州贵阳花溪清华中学高一上月考一化学卷(解析版) 题型:选择题
下列将饱和碘水中的碘单质分离出来的实验操作说法正确的是
A.使用萃取的方法,并选用酒精作萃取剂
B.萃取使用的主要仪器是分液漏斗,在使用前要先检验其是否漏液
C.分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一烧杯中
D.从分液漏斗中分离出的就是纯净的碘单质
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江大庆实验中学高三上期中化学卷(解析版) 题型:实验题
氯元素的单质及其化合物在生产生活中应用极其广泛。请完成下列填空:
Ⅰ:氯气性质探究
设计下图实验装置来制备并验证氯气的性质(部分夹持装置未画出)。

(1)A中放置固体二氧化锰的装置名称是___________________。
(2)装置B的作用是___________________。
(3)硬质玻璃管C中事先装有两个沾有相关试剂的棉球,左侧棉球的实验现象为 。
(4)D中的NaOH溶液用来吸收尾气,向反应后的D中加入足量稀硫酸会产生气体,写出该反应的离子方程式 。
Ⅱ:制备HClO
(5)设计装置E代替上图的装置C,用于制备较高浓度的HClO溶液。在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙。
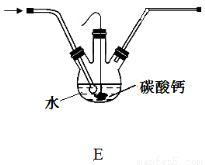

①该方案可以制得较高浓度HClO的原因是(结合必要的化学语言回答) 。
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除HClO外,还含有 、 (写两种钙盐的化学式,一种正盐,一种酸式盐);该小组同学测得反应中碳酸钙质量减少M g,反应后从所得的200mL溶液中取用10mL与足量稀盐酸混合,连接F装置测得产生的气体体积为V L(已换算成标准状况),则原溶液中含钙正盐的浓度为 mol·L-1(用含M、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上期中化学试卷(解析版) 题型:实验题
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
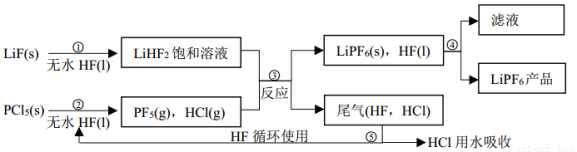
已知: HCl的沸点是-85.0℃,HF的沸点是 19.5℃。
(1)第①步反应中无水 HF 的作用是_____________、___________。反应设备不能用玻璃材质的原因是_______________(用化学方程式表示)。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:____________。
(3)第④步分离采用的方法是__________;第⑤步分离尾气中 HF、 HCl 采用的方法是__________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学卷(解析版) 题型:实验题
工业上可以用废铁屑制备活性Fe3O4,流程如下图:
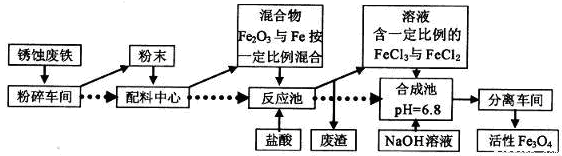
(1)在制备过程中,不但要将块状固体原料粉碎、磨成粉末,作用是_____________。
(2)在合成池里生成Fe3O4的离子方程式为_____________。
(3)根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近_____________。
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3·6H2O晶体,同时测定混合物中铁的质量分数,装置如右图(夹持装置略,气密性已检验):
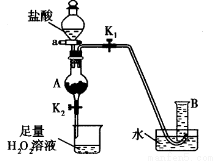
操作步骤如下:
Ⅰ.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13·6H2O晶体。
请回答:
①操作Ⅱ中“……”的内容是_ ,烧杯中的现象是 ,相应的方程式是_ ___、___ _。(是离子反应的写离子方程式)
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是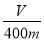 ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是 。
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com