
 在一定条件下进行下列可逆反应的实验:A(g)+2B(g)?3C(g);△H>0
在一定条件下进行下列可逆反应的实验:A(g)+2B(g)?3C(g);△H>0 | 反应条件 | 温度 | 容器体积 | 起始n(A) | 起始n(B) | 其他条件 |
| Ⅰ组 | 500℃ | 1L | 1mol | 2mol | 无 |
| Ⅱ组 | 500℃ | 1L | 2mol | 4mol | 无 |
| Ⅲ组 | 500℃ | 1L | 1mol | 2mol |
 ,故答案为:
,故答案为: ;
;| 2a%mol |
| 2mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A、可能在同一平面上的原子最多有20个 |
| B、12个碳原子不可能都在同一平面上 |
| C、所有的原子都在同一平面上 |
| D、除苯环外的其余碳原子有可能都在一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 符合的条件 | 物质的化学式或名称 |
| (1) | 混合物 | |
| (2) | 电解质,但熔融状态下并不导电 | |
| (3) | 电解质,但难溶于水 | |
| (4) | 化合物,但不是电解质 | |
| (5) | 不是电解质,但本身能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
. |
| v |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
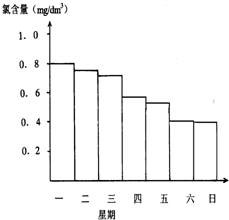 游泳池水的含氯气量应该控制在0.5mg/L至1.0mg/L之间,
游泳池水的含氯气量应该控制在0.5mg/L至1.0mg/L之间,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com