
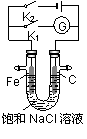
将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是
( )
A.K1闭合,K2断开,铁棒上发生的反应为2H2O+O2+4e-=4OH-
B.K2闭合,K1断开,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体
C.K2闭合,K1断开,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K1闭合,K2断开,石墨棒周围溶液pH逐渐升高
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
下列对于“摩尔”的说法和理解正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
C.国际上规定,0.012kg碳原子所含有的碳原子数目为1摩
D.摩尔是物质的量的单位,简称摩,符号为mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在蒸发皿中加热蒸干下列物质的溶液,再灼烧(溶液低于400℃)可以得到原溶质固体的是( )
A.AlCl3 B.NaHCO3 C.MgSO4 D.KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关沉淀溶解平衡的说法正确的是( )
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,AgCl的Ksp增大
C .在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀
.在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀
D.在CaCO3的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,向Mg(OH)2的澄清饱和溶液中加入少量的NH4Cl固体,c(Mg2+)升高
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的溶解度小于在20 mL 0.01mol/LNH4Cl溶液中的溶解度
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是: 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
 B.2H2(g)+O2(g)=2H2O(1) △H<0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C. NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
(2)以H2SO4溶液为电解质溶液,依据所选反应设计一个原电池,
其正极的电极反应式为
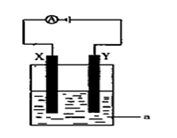
(3)现将你设计的原电池通过导线与下图中电解池相连,其中a为
电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为 。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体为672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的配置或存放正确的是
A. 水晶瓶可存放氢氟酸
B. 水玻璃存放在胶塞细口无色玻璃瓶中
C. 绿矾溶液可长期存放,不必现用现配
D. 氯水存放在胶塞细口棕色玻璃瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物等均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用实验的方法。实验中称取0.54 g的FeClx样品,溶解后加入足量硝酸银溶液,得沉淀1.435g。求出FeClx中x值 (列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
根据要求回答下列问题。
(1)相同质量的SO2气体和SO3气体,其分子数之比为__________,氧原子数之比为__________,相同条件下(同温同压)的体积之比为__________,密度之比为__________。
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O 2的物质的量之比是__________,这种混合气体的密度是同温同压下氧气密度的_______
2的物质的量之比是__________,这种混合气体的密度是同温同压下氧气密度的_______ __倍。
__倍。
(3)用2.4 mol·L-1的H2SO4溶液配制100 mL浓度为0.2 mol·L-1的稀硫酸,需量取2.4 mol·L-1的H2SO4溶液的体积是__________mL。
(4)试分析下列操作对所配溶液的浓度有何影响(填“偏高”“偏低”或“无影响”)。
①未洗涤烧杯和玻璃棒,使所配溶液浓度________;
②定容时俯视刻度线,使所配溶液浓度________;
③摇匀后,发现液面低于刻度线,又滴加蒸馏水,使所配溶液浓度________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com