
| A. | 铁片粉与稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 氧化亚铁粉末溶于盐酸中:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 铜与氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 向硫酸铝溶液中加入过量氨水:Al3++4OH-═AlO2+2H2O |
分析 A.不符合反应客观事实;
B.氧化亚铁化学式错误;
C.二者反应生成氯化亚铁和氯化铜;
D.不符合反应客观事实.
解答 解:A.铁与足量稀硝酸反应生成硝酸铁和一氧化氮和水,不能生成氢气,故A错误;
B.氧化亚铁粉末溶于盐酸中:FeO+2H+═Fe2++H2O,故B错误;
C.铜与氯化铁溶液反应,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故C正确;
D.向硫酸铝溶液中加入过量氨水,离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分、注意离子反应遵循客观事实,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 地球上99%以上的溴蕴藏在海洋中 | |
| B. | 用食醋可除去热水壶内壁的水垢 | |
| C. | 在水库铁闸门上接装铜块可减缓铁闸门腐蚀 | |
| D. | 将煤气化或液化可减少污染、提高燃烧效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱、烧碱均属于碱 | B. | 氧化钠、过氧化钠属于碱性氧化物 | ||
| C. | 液氨、氨水属于混合物 | D. | 氧化铝属于两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g | B. | 0.8g | C. | 1.6g | D. | 16g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液中:Na+、Fe2+、SO42-、NO3- | |
| B. | 某无色溶液中:Mg2+、ClO-、SO42-、Fe2+ | |
| C. | 能使KSCN变红的溶液中:NH4+、Na+、SiO32-、HCO3- | |
| D. | 水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
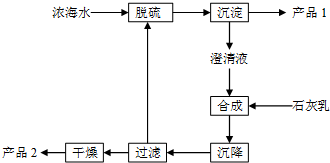 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品. _.
_.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com