
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨比1mol金刚石的总能量高 | |
| D. | 1mol石墨和1mol金刚石的总能量相等 |
分析 在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量说明石墨的能量低于金刚石的能量,石墨更稳定.
解答 解:A、石墨转化为金刚石要吸收能量,说明石墨的能量低,稳定,故A正确;
B、石墨转化为金刚石要吸收能量,说明石墨的能量低,稳定,故B错误;
C、在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量说明石墨的能量低于金刚石的能量,故C错误;
D、1mol石墨转化为金刚石,要吸收1.895kJ的能量说明石墨的能量低于金刚石的能量,故D错误;
故选A.
点评 本题考查金刚石和石墨的转化以及涉及到的能量变化,题目难度不大,明确物质自身具有能量越低越稳定.


科目:高中化学 来源: 题型:解答题
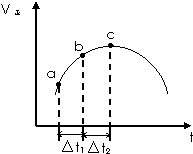 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
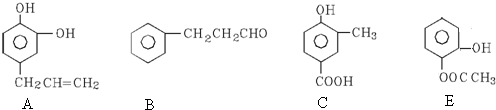
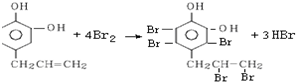 .
.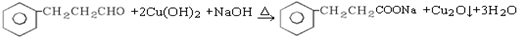 .
.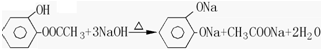 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
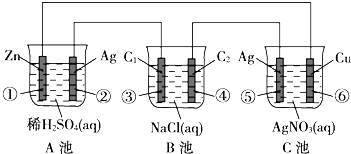 已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)
已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=$\frac{36.5V}{22.4}$ | B. | ω=$\frac{36.5c}{1000ρ}$ | ||
| C. | c=$\frac{1000ρV}{36.5V+22400}$ | D. | c=$\frac{V}{22.4+22.4V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
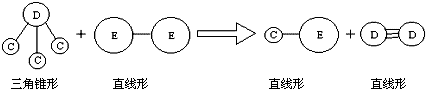
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com