
| A、1L 0.1mol?L-1的氨水中含有的NH3?H2O分子数为0.1NA |
| B、电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA |
| C、标准状况下,2.24L的二氯甲烷中含有的碳氯共价键的数目为0.2NA |
| D、一定条件下,4.6g NO2和N2O4混合气体中含有的N原子数目为0.1NA |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
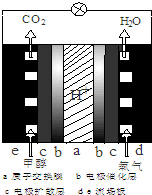 以甲醇为替代燃料是解决我国石油资源短缺的重要措施.
以甲醇为替代燃料是解决我国石油资源短缺的重要措施.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、砹易溶于某些有机溶剂 |
| B、砹化氢很不稳定易分解 |
| C、砹是有色气体 |
| D、砹化银不溶于水或稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积 |
| B、晶胞中原子的配位数分别为:①6,②8,③8,④12 |
| C、金属镁采取③的堆积方式 |
| D、空间利用率的大小关系为:①<②<③<④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铁、硫酸铜、硫酸 |
| B、氢氟酸、空气、纯碱 |
| C、硝酸、胆矾、熟石灰 |
| D、醋酸、食盐水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车排放的尾气和燃煤排放颗粒污染物是形成雾霾的重要因素 |
| B、为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| C、高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| D、“低碳”生活倡导节能减排,禁止使用化石燃料,减少污水排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
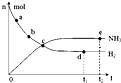 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的正反应速率比点b的大 |
| B、点c处反应达到化学平衡状态 |
| C、点d和点e处的n(N2)不相同 |
| D、点e反应达到化学平衡状态,反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol硫酸中含有4mol氧原子 | ||
B、1个H2SO4分子的质量约是
| ||
| C、硫酸的摩尔质量是98g | ||
| D、6.02×1023个H2SO4分子的质量约是98g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解水制取氢气是理想且经济的制氢方法 |
| B、利用化石燃料燃烧放热使水分解是理想的制氢方法 |
| C、氢燃料电池汽车的使用可以有效减少城市空气污染 |
| D、发展氢燃料电池汽车不需要安全、高效的储氢技术 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com